题目内容
 (2012?丰台区二模)回答下列问题.
(2012?丰台区二模)回答下列问题.(1)铁在食品防腐上有重要的作用.为防止月饼变质,常在内包装中放入一小包防腐剂,其主要成分是铁粉.铁粉的作用是
吸收氧气和水分
吸收氧气和水分
.(2)将锌粉加入到由AgNO3和Cu(NO3)2组成的一定质量的混合溶液中,充分反应后过滤,向滤渣中加入稀盐酸发现有气体逸出,则滤渣的组成为
Zn、Cu、Ag
Zn、Cu、Ag
,滤液中的溶质是Zn(NO3)2
Zn(NO3)2
.(3)用如图所示装置进行下列实验,向“人”字型管的甲、乙两端分别装入适量表中所示物质,并进行相应操作,填写下表.
| 甲中的物质 | 乙中的物质 | 操 作 | 现 象 |
| 饱和石灰水 | 浓硫酸 | 盖上塞子,较长时间后 | ① 甲中有沉淀产生(有固体析出) 甲中有沉淀产生(有固体析出) |
| 碳酸钠溶液 | 盖上塞子,倾斜装置,使乙中液体流入甲中 | ② 甲中有沉淀产生 甲中有沉淀产生 | |
| 少量碳酸钙固体 | 向乙中滴入少量稀盐酸后盖上塞子 | ③ 乙中有无色气泡产生,甲中有沉淀产生 乙中有无色气泡产生,甲中有沉淀产生 | |
| 底部有少量KNO3固体的KNO3溶液 | 将甲、乙两端同时放入热水中 | ④ 甲中石灰水变浑浊,乙中固体逐渐溶解 甲中石灰水变浑浊,乙中固体逐渐溶解 | |
| ⑤甲中 Mg (合理均可) Mg (合理均可) |
乙中 稀盐酸(合理均可) 稀盐酸(合理均可) |
倾斜装置,使乙中液体流入甲中 | 甲中有无色气泡产生 |
分析:(1)铁可与空气中的水分和氧气反应生成铁锈;
(2)氢前金属可置换出酸中的氢,排在金属活动性顺序中前面的金属一般能把排在后面的金属从其盐溶液里置换出来;
(3)根据甲、乙所装物质的性质及反应现象分析解答.
(2)氢前金属可置换出酸中的氢,排在金属活动性顺序中前面的金属一般能把排在后面的金属从其盐溶液里置换出来;
(3)根据甲、乙所装物质的性质及反应现象分析解答.
解答:解:(1)铁可吸收空气中的水分和氧气反应生成铁锈,所以可作防腐剂;
故答案为:
吸收氧气和水分;
(2)Zn、Cu、Ag三种金属中最强的是锌,排在氢的前面,故锌可置换出AgNO3和Cu(NO3)2的银和铜;滤渣中加入稀盐酸发现有气体逸出,说明滤渣中有排在氢前的金属,故一定含有锌,说明锌过量,故滤渣中含有Zn、Cu、Ag;锌与 AgNO3和Cu(NO3)2反应均生成硝酸锌,锌过量,所以滤液中的溶质是Zn(NO3)2;
故答案为:
Zn、Cu、Ag; Zn(NO3)2;
(3)①浓硫酸具有吸水性,盖上塞子,较长时间后甲中的部分水转化为水蒸气被吸收,水分减少,所以甲中有溶质析出;
故答案为:
甲中有沉淀产生(有固体析出);
②氢氧化钙和碳酸钠反应生成碳酸钙沉淀,所以倾斜装置,使乙中液体流入甲中将会看到:甲中有沉淀产生;
故答案为:
甲中有沉淀产生;
③乙中是碳酸钙,向乙中滴入少量稀盐酸后盖上塞,二者会相互反应生成二氧化碳,故乙中有无色气泡产生;二氧化碳能使澄清的石灰水变浑浊,故甲中有沉淀产生;
故答案为:
乙中有无色气泡产生,甲中有沉淀产生;
④氢氧化钙的溶解度随温度的升高而减小,硝酸钾的溶解度随温度的升高而增大;故将甲、乙两端同时放入热水中,会观察到甲中石灰水变浑浊,乙中固体逐渐溶解;
故答案为:
甲中石灰水变浑浊,乙中固体逐渐溶解;
⑤倾斜装置,使乙中液体流入甲中,甲中有无色气泡产生,说明乙中是液体物质,与甲中物质可反应生成无色气体;二氧化锰与双氧水混合生成氧气,氢前金属与稀盐酸或稀硫酸反应生成氢气,碳酸钙与稀盐酸反应生成二氧化碳均符合条件;
故答案为:Mg; 稀盐酸(两空所选物质要符合条件,合理均可).
故答案为:
吸收氧气和水分;
(2)Zn、Cu、Ag三种金属中最强的是锌,排在氢的前面,故锌可置换出AgNO3和Cu(NO3)2的银和铜;滤渣中加入稀盐酸发现有气体逸出,说明滤渣中有排在氢前的金属,故一定含有锌,说明锌过量,故滤渣中含有Zn、Cu、Ag;锌与 AgNO3和Cu(NO3)2反应均生成硝酸锌,锌过量,所以滤液中的溶质是Zn(NO3)2;
故答案为:
Zn、Cu、Ag; Zn(NO3)2;
(3)①浓硫酸具有吸水性,盖上塞子,较长时间后甲中的部分水转化为水蒸气被吸收,水分减少,所以甲中有溶质析出;
故答案为:
甲中有沉淀产生(有固体析出);
②氢氧化钙和碳酸钠反应生成碳酸钙沉淀,所以倾斜装置,使乙中液体流入甲中将会看到:甲中有沉淀产生;
故答案为:
甲中有沉淀产生;
③乙中是碳酸钙,向乙中滴入少量稀盐酸后盖上塞,二者会相互反应生成二氧化碳,故乙中有无色气泡产生;二氧化碳能使澄清的石灰水变浑浊,故甲中有沉淀产生;
故答案为:
乙中有无色气泡产生,甲中有沉淀产生;
④氢氧化钙的溶解度随温度的升高而减小,硝酸钾的溶解度随温度的升高而增大;故将甲、乙两端同时放入热水中,会观察到甲中石灰水变浑浊,乙中固体逐渐溶解;
故答案为:
甲中石灰水变浑浊,乙中固体逐渐溶解;
⑤倾斜装置,使乙中液体流入甲中,甲中有无色气泡产生,说明乙中是液体物质,与甲中物质可反应生成无色气体;二氧化锰与双氧水混合生成氧气,氢前金属与稀盐酸或稀硫酸反应生成氢气,碳酸钙与稀盐酸反应生成二氧化碳均符合条件;
故答案为:Mg; 稀盐酸(两空所选物质要符合条件,合理均可).
点评:本题考查知识比较综合,涉及到铁生锈,金属、酸、碱、盐的性质,物质的溶解度受温度变化的影响等知识,掌握相关知识才能正确解答.

练习册系列答案
相关题目
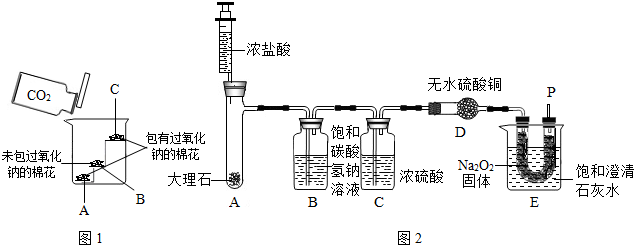
 (2012?丰台区二模)工业纯碱中常含有少量的NaCl杂质.右图是测定纯碱样品中Na2CO3质量分数的实验装置(气密性良好,样品质量为11.0g,装置D的质量为172.2g).操作步骤为:将样品装入广口瓶中→打开止水夹,缓缓鼓入空气数分钟→连接装置D→关闭止水夹,向盛有样品的广口瓶中滴加稀硫酸至不再产生气泡→打开止水夹,再缓缓鼓入空气数分钟→称量装置D的质量为176.6g.(假设每套装置均反应完全).
(2012?丰台区二模)工业纯碱中常含有少量的NaCl杂质.右图是测定纯碱样品中Na2CO3质量分数的实验装置(气密性良好,样品质量为11.0g,装置D的质量为172.2g).操作步骤为:将样品装入广口瓶中→打开止水夹,缓缓鼓入空气数分钟→连接装置D→关闭止水夹,向盛有样品的广口瓶中滴加稀硫酸至不再产生气泡→打开止水夹,再缓缓鼓入空气数分钟→称量装置D的质量为176.6g.(假设每套装置均反应完全).