题目内容
(2012?丰台区二模)向原煤中加入适量生石灰可有效地减少二氧化硫的排放,削弱二氧化硫对空气的污染.
(1)请完成该反应的化学方程式:2CaO+2SO2+
2CaSO4;
(2)若加入含氧化钙5.6g的生石灰,理论上最多可吸收二氧化硫多少克?
(1)请完成该反应的化学方程式:2CaO+2SO2+
O2
O2
| ||
(2)若加入含氧化钙5.6g的生石灰,理论上最多可吸收二氧化硫多少克?
分析:(1)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物中横线上物质的化学式.
(2)根据参加反应生石灰的质量,由反应的化学方程式计算出理论上最多可吸收二氧化硫的质量即可.
(2)根据参加反应生石灰的质量,由反应的化学方程式计算出理论上最多可吸收二氧化硫的质量即可.
解答:解:(1)根据反应的化学方程式,生成物中钙、硫、氧原子个数分别为2、2、8,反应物中钙、硫、氧原子个数分别为2、2、6,根据反应前后原子种类、数目不变,则则每个横线上物质的分子由2个氧原子构成,则物质X的化学式为O2.故答案为:O2.
(2)设理论上最多可吸收二氧化硫的质量为x,
2CaO+2SO2+O2
2CaSO4
112 128
5.6g x
=
x=6.4g
答:理论上最多可吸收二氧化硫的质量为6.4g.
(2)设理论上最多可吸收二氧化硫的质量为x,
2CaO+2SO2+O2
| ||
112 128
5.6g x
| 112 |
| 128 |
| 5.6g |
| x |
答:理论上最多可吸收二氧化硫的质量为6.4g.
点评:本题难度不大,掌握化学反应前后元素守恒、原子守恒来确定物质的化学式、根据化学方程式的计算即可正确解答本题.

练习册系列答案
相关题目
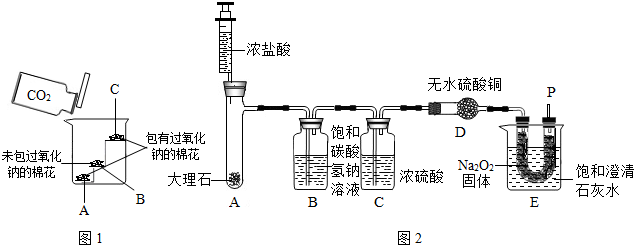
 (2012?丰台区二模)工业纯碱中常含有少量的NaCl杂质.右图是测定纯碱样品中Na2CO3质量分数的实验装置(气密性良好,样品质量为11.0g,装置D的质量为172.2g).操作步骤为:将样品装入广口瓶中→打开止水夹,缓缓鼓入空气数分钟→连接装置D→关闭止水夹,向盛有样品的广口瓶中滴加稀硫酸至不再产生气泡→打开止水夹,再缓缓鼓入空气数分钟→称量装置D的质量为176.6g.(假设每套装置均反应完全).
(2012?丰台区二模)工业纯碱中常含有少量的NaCl杂质.右图是测定纯碱样品中Na2CO3质量分数的实验装置(气密性良好,样品质量为11.0g,装置D的质量为172.2g).操作步骤为:将样品装入广口瓶中→打开止水夹,缓缓鼓入空气数分钟→连接装置D→关闭止水夹,向盛有样品的广口瓶中滴加稀硫酸至不再产生气泡→打开止水夹,再缓缓鼓入空气数分钟→称量装置D的质量为176.6g.(假设每套装置均反应完全).