题目内容
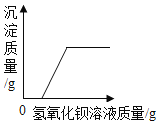
【题目】向一定质量的 CaCl2 和 HCl 的混合溶液中逐滴加入溶质质量分数为 10.6%的 Na2CO3 溶液,实验过程 中加入 Na2CO3 溶液的质量与产生沉淀或气体的质量关系如图所示。下列说法错误的是( )(相对原子质量:H-1,0-16,C-12,Na-23,Ca-40)
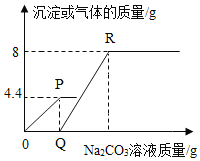
A.R 点对应横坐标的数值为 180
B.0 至 P 过程中溶液的 pH 变大
C.P 点时的溶液只含一种溶质
D.Q 至 R 段表示生成沉淀的过程
【答案】C
【解析】
根据加入的碳酸钠先与盐酸反应,把盐酸消耗完了,才开始与氯化钙反应,开始生成沉淀,最后到达最高点说明已经反应完了进行分析。
A、根据题意可知碳酸钠先与盐酸反应,再与氯化钙反应,由图示可知碳酸钠与盐酸反应生成气体4.4g,碳酸钠与氯化钙反应,生成沉淀8.0g。
设生成4.4g气体所需的Na2CO3的质量为x,生成沉淀8g所需Na2CO3的质量为y,
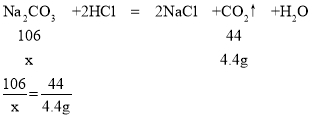
x=10.6g;

y=8.48g;
所以R点对应的坐标数字为:![]() =180g,故正确;
=180g,故正确;
B、O至P过程中盐酸逐渐被消耗,故溶液的pH变大,正确;
C、到达P点,碳酸钠与盐酸恰好完全反应,生成氯化钠,同时还有氯化钙,溶质是两种,错误;
D、Q至R段表示生成沉淀的过程,正确;
故选:C。

【题目】紫甘蓝汁是一种酸碱指示剂。加入氢氧化钠溶液的紫甘蓝汁由紫变黄,再加入干冰,甘蓝汁又由黄色变为绿色。兴趣小组同学分析甘蓝汁由黄色变绿色的原因。甲组同学猜想CO2与水反应生成的碳酸使溶液变绿。乙组同学猜想CO2与NaOH反应导致溶液变绿。
[实验]向紫甘蓝汁中吹气,发现紫甘蓝汁略微变红,甲组猜想不正确。 向氢氧化钠溶液中吹气,没有看到明显现象。
为探究CO2与NaOH溶液发生的反应,兴趣小组尝试用不同的方式进行实验。
[查阅资料]
I、20°C时,几种物质在水中的溶解度见下表:
物质 | Na2CO3 | NaHCO3 | Ca(OH)2 | Ba(OH)2 |
溶解度/g | 21.5 | 9.6 | 0.165 | 3.89 |
Ⅱ .本实验条件下,Na2CO3溶液和NaHCO3溶液的pH分别约为11.0 和8.5。
Ⅲ、氢氧化钠易溶于酒精,碳酸钠微溶于酒精。
[实验探究]
(1)实验一:小雨取一充满 CO2的矿泉水瓶,加入一定量的水, 立即拧紧瓶盖,振荡,发现瓶子变瘪,小雨另取一相同的充满CO2 的矿泉水瓶,向其中加入与水等体积的NaOH溶液,立即拧紧瓶盖,振荡,得到溶液X,此时观察到的现象是________________,实验中,小雨采用两只矿泉水瓶做对比实验的目的是________________。
(2)实验二:为检验CO2与NaOH溶液反应的产物,小亮取实验所得溶液 X少许,向其中滴加BaCl2 溶液,有白色沉淀产生,该反应的化学方程式为_________________,实验中不宜将BaCl2溶液换成Ca(OH)2溶液的原因是________________。
(3)实验三:向氢氧化钠的酒精溶液中吹气,溶液出现__________________,证明有新物质生成。
(4)实验四:兴趣小组将CO2持续通入一定浓度一定量的NaOH溶液中,用数字化实验技术测定反应过程中溶液的pH和温度变化,结果如图1、图2所示。
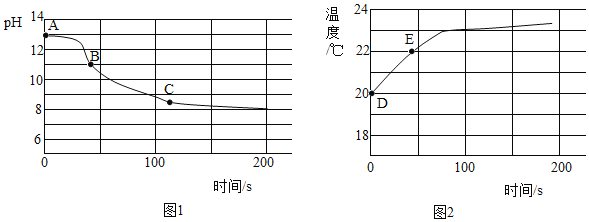
图1中,BC段发生反应的化学方程式为___________________。
图2中,DE段温度变化的原因是__________________。
[反思感悟]
(5)实验从CO2减少、NaOH 减少,Na2CO3 生成等物质的变化,以及____________转化等视角多维度探究CO2与NaOH发生了反应,溶液变绿的原因是CO2与NaOH反应导致。对于现象不明显的化学反应,可以通过现代技术手段进行数据测定,实现反应过程的“可视化”。
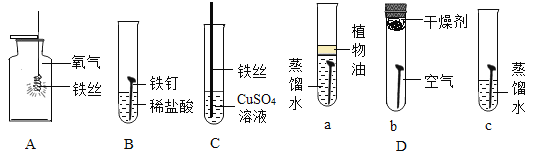
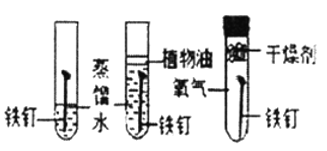
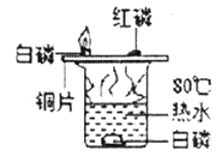
【题目】下列实验设计不能达到实验目的是( )
选项 | A | B | C | D |
实验目的 | 除去CO中的CO2,并回收CO | 探究可燃物燃烧所需的条件 | 除去氧化铜粉末中的铜粉 | 鉴别NH4NO3、CuSO4和NaCl三种白色粉末 |
实验设计 |
|
|
|
|
A. A B. B C. C D. D