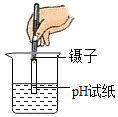
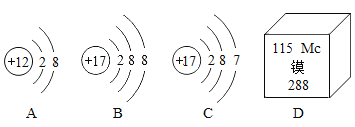
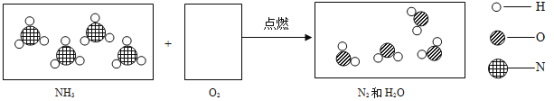
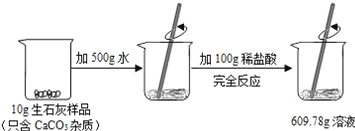
��Ŀ����
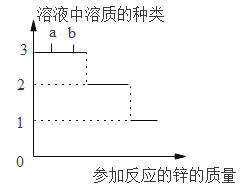
����Ŀ����ͼ�Ǽס��ҡ������ֹ������ʵ��ܽ�����ߡ�����ͼ�е���Ϣ�ش��������⣺
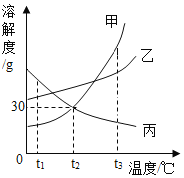
��1��tl��ʱ�����ܽ��______�ҵ��ܽ��(�>������<������)��
��2��t2��ʱ��20g���ܽ���50gˮ���γ�________g��Һ��
��3����Ҫ���ı�����Һת��Ϊ��������Һ�ɲ��õ�һ�ַ��� �� ________��
��4��t3��ʱ�����ס��ҡ����������ʵı�����Һ������t2�棬������Һ���������������ɴ�С����____________��
���𰸡�< 65 �����¶ȣ��������ܼ��ȣ� ��>��>��
��������
��1����ͼ����Ϣ��֪��tl��ʱ�����ܽ��<�ҵ��ܽ�ȣ�
��2��t2��ʱ�������ܽ����30g����t2��ʱ����100gˮ�������ܽ�30g�����ʣ�20g���ܽ���50gˮ�У�ֻ�ܽ�15g���γ�65g��Һ��
��3�����ܽ�����¶����߶�������Ҫ���ı�����Һת��Ϊ��������Һ�ɲ��õ�һ�ַ����������¶ȣ��������ܼ��ȣ���
��4��t3��ʱ�����ס��ҡ����������ʵı�����Һ���µ�t2�����ס��ҵ��ܽ�ȼ�С���������壬��t2���ı�����Һ��![]() ������t2��ʱ���ҵ��ܽ�ȱȼĴ�������Һ���ʵ�������������>�ף�����ʱ�������ܽ�ȱ�����ʲ���������Һ�����ʵ������������䣬����t3��ʱ������Һ���ʵ���������������t3��ʱ���ܽ�ȱȼ���t2��ʱ���ܽ��С��������Һ����������������>�������µ�t2������������������Һ���ʵ�����������С��ϵ����>��>����
������t2��ʱ���ҵ��ܽ�ȱȼĴ�������Һ���ʵ�������������>�ף�����ʱ�������ܽ�ȱ�����ʲ���������Һ�����ʵ������������䣬����t3��ʱ������Һ���ʵ���������������t3��ʱ���ܽ�ȱȼ���t2��ʱ���ܽ��С��������Һ����������������>�������µ�t2������������������Һ���ʵ�����������С��ϵ����>��>����

 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�����Ŀ���ҹ���һ�������������������Ϊ�����һ��ij��ѧʵ��С���ͬѧ�������װ����ʵ������ģ�����������������һ��������̽����
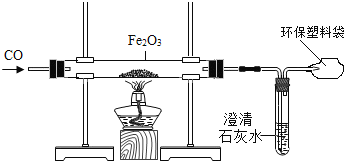
��1������˳����ʵ��ɰܵĹؼ������ڸ�ʵ�飬Ӧ______________________��������ͨ��һ����̼�������ȵ�ȼ�ƾ���������
��2����Ӧ�пɹ۲쵽�ֲ������ڵĹ�������_________ɫ���__________ɫ��д���÷�Ӧ�Ļ�ѧ����ʽ____________________��
��3������ļ��飺
���������飺��ͬѧ��Է�Ӧ��IJ�����г������飬����������һ������������____��
����һ����֤����ͬѧ���û�ѧ�����Բ����һ����֤��������Ӧ��ĺ�ɫ��ĩ��������������ͭ��Һ�У�����ֻ�в��ֱ�졣��д�����ɺ�ɫ���ʵĻ�ѧ����ʽ��_____��
��4��������̽����
����ͬѧ�Բ���ijɷֲ��������ɣ������������֮���֪��һ����̼��ԭ��������һ���Ĺ��̡�
������Fe2O3����ԭΪFe3O4��3Fe2O3 + CO ![]() 2Fe3O4 + CO2��
2Fe3O4 + CO2��
Ȼ����Fe3O4����ԭΪFeO��______![]() ______��
______��
�����FeO����ԭΪFe��FeO + CO Fe + CO2
Fe + CO2
��ͨ�����Ϸ�����������λͬѧ�Է�Ӧ���ɫ����ijɷֽ����˲��룺
��֪��FeO��Fe3O4��Ϊ��ɫ����Fe3O4�д��ԡ�FeO��Fe3O4����������ͭ��Һ��Ӧ��
����һ��Fe��Fe3O4�� �������Fe��FeO�� ��������Fe��Fe3O4��FeO��
��Ϊ�˶Բ������ijɷֽ��и��۵ķ���������ͬѧ������ʵ���������£�
ʵ������ | ʵ������ | ʵ����� |
����Ӧ��õ��ĺ�ɫ��ĩ �ô������� | ________ | ����һ ���� |
����Ӧ��õ��ĺ�ɫ��ĩ ��������������ͭ��Һ�� | ________ |
��ʵ�鷴˼��Ϊ��������IJ��ʣ�Ӧ�ʵ�________�������������������������Ӧ�¶ȡ�