题目内容
【题目】【2016年湖北省荆州市】向一定量的NaCl溶液中加入足量的AgNO3溶液,所得沉淀的质量为原NaCl溶液质量的一半.则原NaCl溶液中溶质的质量分数最接近于( )
A.10% B.20% C.30% D.40%
【答案】B
【解析】假设生成氯化银的质量为a,设氯化钠的质量为x;
NaCl+AgNO3═AgCl↓+NaNO3
58.5 143.5
x a
58.5:x=143.5:a,解得x=58.5a/143.5,所以原NaCl溶液中溶质的质量分数:ω= (58.5a/143.5÷2a)×100%≈20%,选项B正确。

 阅读快车系列答案
阅读快车系列答案【题目】实验室常用下列装置来制取、收集气体.仪器b是分液漏斗,可通过旋转活塞分次滴加液体.请回答以下问题.
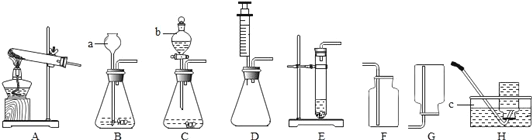
(1)仪器a、c的名称是:a______,c____________.
(2)实验室用KMnO4制取02,应选用的发生装置和收集装置的组合为____________(填字母序号),该发生装置的不足之处是____________,该反应的化学方程式是____________.收集装置的选择是由气体的性质决定的.既能用排水法也能用排空气法收集的气体一定具有的性质有____________(填数字序号)
①易溶于水 ②难溶于水 ③不与水反应 ④密度与空气接近
⑤可与空气中某成分反应 ⑥有毒,是一种大气污染物
(3)某同学取一定浓度盐酸与石灰石反应,将生成的气体通入澄清石灰水中,始终未见浑浊,请将可能的原因填入下表,并用简单的实验进行验证:
可能的原因 | 实验步骤 | 实验现象 | 实验结论 |
原因:______ | _______ | _____ | 猜想的结论正确 |
(4)化学反应可控制才能更好地为人类造福,我们可以通过改变反应的条件、药品用量、改进装置等途径来达到控制反应的目的。常温下块状电石(CaC2)与水反应生成乙炔 (C2H2)气体和氢氧化钙,该反应的化学方程式是____________,实验室制取乙炔时,须严格控制加水速度,以免剧烈反应放热引起装置炸裂.图中适合制取乙炔气体的发生装置有____________(填装置序号)。
【题目】九年级(三)班化学兴趣小组为测定大理石中碳酸钙的含量,如下图所示:
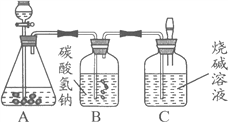
将过量的稀盐酸加入到20 g大理石中(其他成分不与盐酸反应),把产生的CO2气体用足量的烧碱溶液吸收,同时测量C瓶烧碱溶液增加的质量,结果如下表所示:
时间 / 分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
C增加质量/C | 0 | 3.0 | 5.0 | 6.0 | 6.6 | x | 6.6 |
(1)上表中,第10分钟时,x= 。
(2)计算大理石样品中碳酸钙的质量分数。
(3)请在下图的坐标纸上,以时间为横坐标,以产生CO2气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线;
(4)B中所装药品为碳酸氢钠溶液,作用是吸收可能挥发的HCl气体,你认为对测量结果有没有影响? (填“有”或“没有”)