题目内容
【题目】下列实验观察现象,描述正确的是( )
A. 硫在空气中燃烧:发出蓝紫色火焰,产生有刺激性气味的气体,放热
B. 一氧化碳还原氧化铁,红棕色固体逐渐变成黑色,产生二氧化碳气体
C. 生石灰中加入一定量的水,观察不到明显现象
D. 研磨氯化铵与熟石灰混合粉末,产生刺激性气味的气体
【答案】D
【解析】A. 硫在氧气中燃烧:发出蓝紫色火焰,产生有刺激性气味的气体,放热,错误;B. 一氧化碳还原氧化铁,红棕色固体逐渐变成黑色,产生使澄清石灰水变浑浊的气体,错误;C. 生石灰中加入一定量的水,放出大量的热,错误;D. 研磨氯化铵与熟石灰混合粉末,产生刺激性气味的气体,正确。故选D。

【题目】某实验小组同学欲通过实验探究金属的性质。
【实验目的】证明金属活动性强弱:Al > Cu
【设计并实施实验】小组内的3位同学分别做了下述实验:
实验 | 现象 | |
甲 | 将铝片直接放入到稀CuCl2溶液中 | 一段时间后才出现了预期的实验现象 |
乙 | 将用砂纸打磨过的铝片放入稀CuCl2溶液(与甲实验浓度相同)中 | 十几秒内即观察到明显现象。 |
丙 | 将用砂纸打磨过的铝片放入稀CuSO4溶液中 | 在与乙相同的时间内没有观察到明显现象 |
(1)实验中,预期的实验现象是________。
(2)对比甲、乙两位同学的实验,推测甲同学开始时没有观察到明显实验现象的原因是________。
该小组同学进一步对实验进行探究。
【提出问题】为什么打磨过的铝片放入到CuCl2溶液和CuSO4溶液中观察到的现象不同呢?
【微观探析】查阅资料可知两个反应的微观示意图如下。

(3)图1反应的化学方程式为________;Al和CuCl2溶液、CuSO4溶液反应的微观本质是Al和Cu2+反应生成 Al3+和______ 。
【提出猜想】根据上述图示,小组同学提出了如下猜想。
猜想1:产生现象不同的原因是CuCl2溶液比CuSO4溶液中含有的Cu2+浓度大。
猜想2:溶液中Cl-对Al和Cu2+反应有促进作用。
猜想3:溶液中SO42-对Al和Cu2+反应有阻碍作用。
【设计并实施实验】
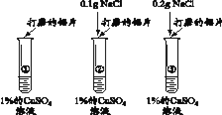
序号 | 实验方案及操作 | 现象 | 结论 |
1 | 乙、丙两位同学取Cu2+浓度相同的CuCl2溶液和CuSO4溶液重复实验。 | 与上述乙、丙同学实验现象相同 | 猜想1______(填“成立”或“不成立”) |
2 |
| 在同一时间内,③最快产生现象,②次之,①无明显现象 | 猜想2成立 |
(5)甲同学认为通过实验2得到的结论证据不充足,其理由是溶液中的__________ 对实验可能有干扰。
(6)丙同学通过查阅资料排除了上述干扰,并模仿实验2又设计了一组3支试管的实验,证明了猜想3也成立。请在下列方框中画出实验设计图示。__________