题目内容
欲使6.5g锌跟20%的稀硫酸完全反应,需要这种稀硫酸多少克?
解:设需要纯硫酸的质量为X.
Zn+H2SO4=ZnSO4+H2↑
65 98
6.5克 X
 ═
═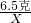
得:X=9.8克
∴20%的稀硫酸的质量=9.8克÷20%═49克.
答:需要20%的稀硫酸49克.
分析:先写出化学方程式并代入锌的质量计算出纯硫酸的质量,然后计算硫酸溶液的质量.
点评:掌握计算格式和规范性,注意:参加反应的物质是溶质,然后把溶质的质量转化为溶液的质量.
Zn+H2SO4=ZnSO4+H2↑
65 98
6.5克 X
 ═
═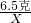
得:X=9.8克
∴20%的稀硫酸的质量=9.8克÷20%═49克.
答:需要20%的稀硫酸49克.
分析:先写出化学方程式并代入锌的质量计算出纯硫酸的质量,然后计算硫酸溶液的质量.
点评:掌握计算格式和规范性,注意:参加反应的物质是溶质,然后把溶质的质量转化为溶液的质量.

练习册系列答案
相关题目