��Ŀ����
����Ŀ����ʽ̼��ͭ��Cux��OH��y��CO3��z����һ����;�㷺�Ļ���ԭ�ϣ�ʵ������ȡ��ʽ̼��ͭ�IJ������¡�
��֪����Cu+4HNO3��Ũ����Cu��NO3��2+2NO2��+4H2O����2NO2+2NaOH��NaNO3+NaNO2+H2O
����һ����Na2CO3
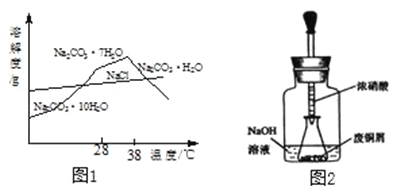
��Na2CO3��Һ��������NaCl���ᴿ���Na2CO3����IJ������£�����Ũ����38�����Ͻᾧ�����ȹ��ˣ�ϴ�ӣ�������ˮ����Na2CO3���塣�����ͼ1�ش�
��1��38�����Ͻᾧ��Ŀ����_____��
��2��ϴ��ʱ�����˵��Լ���_____��
a��ˮ b��ˮ c���� dCa��OH��2��Һ
���������Cu��NO3��2
��ͼ2���õι���ȡŨHNO3�����ӵ���ƿ�ڵķ�ͭм�У���ͭм����������ַ�Ӧ����ˣ��õ�Cu��NO3��2��Һ��
����������ʽ̼��ͭ���Ʊ�
����Թ��м���Na2CO3��Һ��Cu��NO3��2��Һ��ˮԡ������70�����ң���NaOHϡ��Һ����pH��8.5�������ã����ˣ�����ˮϴ�ӣ���ɣ��õ���ʽ̼��ͭ��Ʒ��
��3����ͼװ����NaOH��Һ��������_____����Ӧ�������ƿ����Һ�е�������NaOH��_____��_____����д��ѧʽ����
��4���������У�ˮԡ��������������_____��_____ �����ȡ��г�������ʯ�������⣩��ϴ�ӵ�Ŀ����_____��
��5��Ӱ���Ʒ��������Ҫ������_____��_____��
��6�����ȼ�ʽ̼��ͭ��Cux��OH��y��CO3��z����40 g CuO��3.6 g H2O����x��y��z��_____��
���𰸡��õ�Na2CO3H2O���壬���̼�����ˮ��ʱ�� a ����NO2 NaNO3 NaNO2 �ձ� �¶ȼ� ��ȥNaNO3 pH �¶� 5��4��3
��������
��1������ͼ��֪��38�����Ͻᾧ�õ���̼���ƾ��庬�ᾧˮ�٣�ΪNa2CO3H2O���壬���̼�����ˮ��ʱ�䡣
��2�������¶ȸ�ʱ��Na2CO3H2OС������ϴ��ʱ�ܼ�����ʧ������ϴ��ʱ���˵��Լ�����ˮ����ѡ��a��
��3��������Ϣ��֪��2NO2+2NaOH��NaNO3+NaNO2+H2O��������ͼװ����NaOH��Һ������������NO2��������Ϣ��֪�������ﻹ��NaNO3��NaNO2�����Է�Ӧ�������ƿ����Һ�е�������NaOH��NaNO3��NaNO2��
��4���������У�ˮԡ�������������� �ձ����¶ȼ� �������¶���38�������ã���ϴ�ӵ�Ŀ���� ��ȥNaNO3��
��5�����ݹ����п��Ƶķ�Ӧ������֪��Ӱ���Ʒ��������Ҫ������ pH�� �¶ȡ�
��6�����ȼ�ʽ̼��ͭ��Cux��OH��y��CO3��z����40 g CuO��3.6 g H2O����ͭԭ�Ӻ���ԭ�Ӹ�����Ϊ![]() ��5��4����Cu5��OH��4��CO3��z�����ݻ��������������ϼ۵Ĵ�����Ϊ��ɵã�+2����5+����1����4+����2����z��0��z��3��x��y��z��5��4��3��
��5��4����Cu5��OH��4��CO3��z�����ݻ��������������ϼ۵Ĵ�����Ϊ��ɵã�+2����5+����1����4+����2����z��0��z��3��x��y��z��5��4��3��
�ʴ�Ϊ��
��1���õ�Na2CO3H2O���壬���̼�����ˮ��ʱ�䡣
��2��a��
��3������NO2�� NaNO3��NaNO2��
��4���ձ����¶ȼƣ� ��ȥNaNO3��
��5��pH�� �¶ȡ�
��6��5��4��3��

 �����߿����ϵ�д�
�����߿����ϵ�д� �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д� Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�����Ŀ�����з�����ᴿ���ʵķ����У������ݵ�ԭ����ȷ����![]() ����
����![]()
ѡ�� | �����ķ�����ᴿ | ����ԭ�� |
A | ����Һ̬������ȡ���� | ���õ������������۵㲻ͬ |
B | ��ʯ�ͷ���õ�ʯ�Ͳ�Ʒ | ʯ���и��ɷֵ��ܶȲ�ͬ |
C | ��������غ��Ȼ�����ɵĻ���� | ����غ��Ȼ��Ʒֽ��¶Ȳ�ͬ |
D | ��ȥ�����е���ɳ | �Ȼ��ƺ���ɳ���ܽ��Բ�ͬ |
A. A B. B C. C D. D