题目内容
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动,请你和他们一起完成以下实验探究。
(演示实验)将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中,该反应的化学方程式是________。
(查阅资料)溶液显中性
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
(猜想与假设)针对疑问,甲组同学猜想如下:
猜想Ⅰ:只有CaCl2;
猜想Ⅱ:有______;
猜想Ⅲ:有CaCl2和Ca(OH)2;
猜想Ⅳ:有CaCl2、HC1和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是____________
(实验探究)为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加紫色石蕊溶液 | 通入 | 滴加溶液 |
实验操作 |
|
|
|
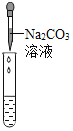
实验现象 | ______ | ______ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
(得出结论)通过探究,全班同学一致确定猜想Ⅲ是正确的。
(评价反思)丙组同学认为滴加溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因______。在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑______。
【答案】Ca(OH)2+2HCl=CaCl2+2H2O HCl和CaCl2 盐酸和氢氧化钙不能共存 溶液变为蓝色 溶液变浑浊 碳酸钠与氯化钙也能产生碳酸钙白色沉淀 反应物是否有剩余
【解析】
演示实验:
稀盐酸与氢氧化钙反应生成氯化钙和水,反应的化学方程式是Ca(OH)2+2HCl=CaCl2+2H2O;
猜想与假设:
稀盐酸和氢氧化钙恰好完全反应时,溶液中的溶质只有氯化钙;当稀盐酸过量时,溶液中的溶质是氯化钙和氯化氢;当氢氧化钙过量时,溶液中的溶质是氯化钙和氢氧化钙。所以猜想Ⅱ:有HCl和CaCl2;乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是盐酸和氢氧化钙不能共存;
实验探究:
滴加紫色石蕊溶液,若溶液中含有Ca(OH)2,溶液呈碱性,紫色石蕊试液变蓝;
二氧化碳气体和氢氧化钙反应,产生碳酸钙白色沉淀,若溶液中含有Ca(OH)2,通入二氧化碳,溶液浑浊;
评价反思:
丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,因为溶液中一定存在氯化钙,碳酸钠与氯化钙也能产生碳酸钙白色沉淀;在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑反应物是否有剩余。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】将只含有碳、氢两种元素的气体燃料放入足量氧气中燃烧,并使生成的气体全部通入如图所示的装置中(假定气体全部被吸收),实验中测得有关数据如下: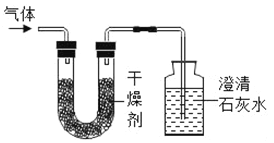
实验前 | 实验后 | |
干燥剂+U形管 | 101.0g | 110.0g |
石灰水+广口瓶 | 310.0g | 327.6g |
(查阅资料)干燥剂的作用是吸收水分;含有碳、氢元素化合物的化学式先写碳,再写氢.
根据实验数据填写下列各空白处:
(1)实验结束后生成物中水的质量为______,二氧化碳的质量为_______.
(2)该燃料中碳元素与氢元素的质量比为_____,该燃料的化学式为_____.
【题目】小强同学经过查阅资料得知:铝丝和铁丝一样,也能在氧气中燃烧,于是设计了如图所示的装置进行实验探究,请你结合实验过程回答下列问题。
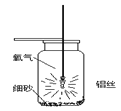
(1)集气瓶底预先铺少量沙子的目的是________。
(2)铝丝下端系一根火柴的目的是:________。
(3)用正确方法引燃铝丝,伸入装有氧气的集气瓶中后,未观察到铝丝发生剧烈燃烧现象,可能的原因是________。
(4)某化学兴趣小组的同学经查阅资料得知:人呼吸中各种气体的体积分数如表所示:
气体 | 吸入气体 | 呼出气体 |
X | 78% | 75% |
Y | 21% | 15% |
二氧化碳 | 0.03% | 3.68% |
水 | 0.02% | 5.44% |
其它 | 0.95% | 0.88% |
①请你判断:表中X是________,Y是________;
②欲证明人呼出的气体中含有水蒸气,其实验方法是___________。