题目内容
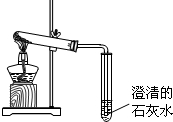 由C、CuO、Fe三种物质组成的混合物,放在试管中,如图所示高温加热.
由C、CuO、Fe三种物质组成的混合物,放在试管中,如图所示高温加热.
当观察到澄清石灰水变浑浊时,停止加热,密封冷却至室温;然后往试管中加入稀硫酸,观察到有气泡冒出,且红色物质明显增加.请根据这些信息,推断红色物质产生和增加的可能的原因(用化学万程式表)
________.
C+2CuO 2Cu+CO2↑,CuO+H2SO4═CuSO4+H2O,CuSO4+Fe═Cu+FeSO4
2Cu+CO2↑,CuO+H2SO4═CuSO4+H2O,CuSO4+Fe═Cu+FeSO4
分析:根据加入稀硫酸,观察到有气泡冒出,且红色物质明显增加,可判断高温反应后的固体含有铁、铜和氧化铜,因此,所涉及的反应为:C在高温条件下能与CuO发生反应生成红色Cu和CO2,铜不能与稀硫酸反应;CuO可与稀硫酸反应生成硫酸铜和水,根据金属活动性铁>氢>铜,铁可与稀硫酸反应放出氢气、铁也可与硫酸铜溶液反应置换出铜.
解答:根据C在高温条件下能与CuO发生反应生成红色的Cu,所以固体物质中含有红色物质;由于剩余的氧化铜能与稀硫酸反应生成硫酸铜,硫酸铜被铁置换又生成铜,所以红色固体明显增加;
故答案为:C+2CuO 2Cu+CO2↑,CuO+H2SO4═CuSO4+H2O,CuSO4+Fe═Cu+FeSO4.
2Cu+CO2↑,CuO+H2SO4═CuSO4+H2O,CuSO4+Fe═Cu+FeSO4.
点评:利用C、CuO、Fe三种物质的性质,根据反应的先后顺序,分析可能发生的反应,并找出与生成红色金属铜相关的反应.
 2Cu+CO2↑,CuO+H2SO4═CuSO4+H2O,CuSO4+Fe═Cu+FeSO4
2Cu+CO2↑,CuO+H2SO4═CuSO4+H2O,CuSO4+Fe═Cu+FeSO4分析:根据加入稀硫酸,观察到有气泡冒出,且红色物质明显增加,可判断高温反应后的固体含有铁、铜和氧化铜,因此,所涉及的反应为:C在高温条件下能与CuO发生反应生成红色Cu和CO2,铜不能与稀硫酸反应;CuO可与稀硫酸反应生成硫酸铜和水,根据金属活动性铁>氢>铜,铁可与稀硫酸反应放出氢气、铁也可与硫酸铜溶液反应置换出铜.
解答:根据C在高温条件下能与CuO发生反应生成红色的Cu,所以固体物质中含有红色物质;由于剩余的氧化铜能与稀硫酸反应生成硫酸铜,硫酸铜被铁置换又生成铜,所以红色固体明显增加;
故答案为:C+2CuO
 2Cu+CO2↑,CuO+H2SO4═CuSO4+H2O,CuSO4+Fe═Cu+FeSO4.
2Cu+CO2↑,CuO+H2SO4═CuSO4+H2O,CuSO4+Fe═Cu+FeSO4.点评:利用C、CuO、Fe三种物质的性质,根据反应的先后顺序,分析可能发生的反应,并找出与生成红色金属铜相关的反应.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
有1包粉末,可能由C、CuO、Fe三种物质中的一种或几种组成.某同学为了探究它的成分,按如下步骤进行实验.
(1)先对实验做了如下设想和分析.取少量粉末于烧杯中,向烧杯中加入过量的稀硫酸,则实验中可能出现的现象与对应结论如下表所示(表中未列完所有情况).请你完成下表.
(2)通过实验及分析,确定该粉末为C、CuO的混合物.为了进一步探究C、CuO的性质,他又利用这种混合物补充做了下面两个实验.
实验1:将此粉末敞口在空气中灼烧完全,待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置.烧杯中 (填“有”或“无”)不溶物,溶液呈 颜色.
实验2:将此粉末隔绝空气加热(若碳完全反应),待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置.请回答:
①烧杯中 (填“有”或“无”)不溶物;
②若静置后溶液呈无色,则该溶液中溶质是 (写化学式);
③若静置后溶液呈蓝色,该实验过程中所发生反应的化学方程式为 、 .
(1)先对实验做了如下设想和分析.取少量粉末于烧杯中,向烧杯中加入过量的稀硫酸,则实验中可能出现的现象与对应结论如下表所示(表中未列完所有情况).请你完成下表.
| 烧杯中可能出现的现象 | 结 论 |
| ① |
只含C |
| ② |
含C、CuO |
| ③有黑色不溶物,有气泡逸出,溶液呈浅绿色 |
实验1:将此粉末敞口在空气中灼烧完全,待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置.烧杯中
实验2:将此粉末隔绝空气加热(若碳完全反应),待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置.请回答:
①烧杯中
②若静置后溶液呈无色,则该溶液中溶质是
③若静置后溶液呈蓝色,该实验过程中所发生反应的化学方程式为
有一包粉末,可能由C、CuO、Fe三种物质中的一种或两种组成.小明同学为了探究它的成分,按如下步骤进行实验.
(1)小明先对实验做了如下设想和分析.取少量粉末于烧杯中,向烧杯中加入过量的稀硫酸,则实验中可能出现的现象与对应结论如下表所示(表中未列完所有情况).请你帮助完成.
(2)通过实验及分析,确定该粉末为C、CuO的混合物.小方想继续探究:木炭在高温条件与氧化铜反应生成的红色粉末的组成.
【查阅资料】①Cu、Cu2O都是红色固体;
②2CuO+C
2Cu+CO2↑,4CuO
2Cu2O+O2↑
③CO+Cu2O
2Cu+CO2,Cu2O+2HCl=CuCl2+Cu+H2O
【猜想】生成的红色粉末究竟是什么?请你和小方一起完成下列猜想:
猜想①Cu; 猜想②Cu2O; 猜想③ .
【设计实验】小方同学设计了一个简单实验很快排除了猜想①,请你帮助他完成下表:
为进一步确定红色粉末的组成,小方利用下列装置,设计了如下实验方案(装置气密性良好).
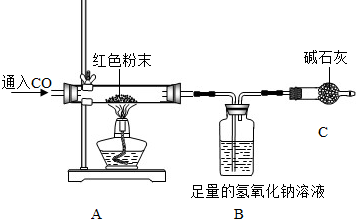
①取红色粉末样品的质量20克; ②测出反应前B装置的总质量为210.0克;
③反应很长时间后测得B装置的总质量为214.4克;④通过计算确定红色粉末的组成.
根据上述实验,回答下列问题:
Ⅰ.实验开始时,先通CO后称量B装置的总质量,再加热,实验目的是
A.排尽装置内空气,防止加热发生爆炸
B.防止装置内的空气影响测量结果
C.防止液体倒流到硬质玻璃管中
Ⅱ.C装置的作用是 .
Ⅲ.为防止实验中尾气对大气的污染,可以对尾气进行收集,现提供水槽和集气瓶,还需一种仪器是 .
Ⅳ.请你根据以上数据通过计算,得出红色粉末组成是 .
Ⅴ.不改变装置和药品,你还可以通过测定 等数据,再通过计算得出红色粉末组成.
【交流反思】小红认为红色粉中的铜,有一部分可能是C与Cu2O在高温下反应生成的,写出反应的化学方程式: .
(1)小明先对实验做了如下设想和分析.取少量粉末于烧杯中,向烧杯中加入过量的稀硫酸,则实验中可能出现的现象与对应结论如下表所示(表中未列完所有情况).请你帮助完成.
| 烧杯中可能出现的现象 | 结论 |
| ①有黑色不溶物,无气泡逸出,溶液呈无色 | 结论:只含 |
| ② |
结论:含C、CuO |
| ③ |
结论:含C、Fe |
【查阅资料】①Cu、Cu2O都是红色固体;
②2CuO+C
| ||
| ||
③CO+Cu2O
| ||
【猜想】生成的红色粉末究竟是什么?请你和小方一起完成下列猜想:
猜想①Cu; 猜想②Cu2O; 猜想③
【设计实验】小方同学设计了一个简单实验很快排除了猜想①,请你帮助他完成下表:
| 实验步骤 | 现象 | 结论 |
| 猜想①不正确 |

①取红色粉末样品的质量20克; ②测出反应前B装置的总质量为210.0克;
③反应很长时间后测得B装置的总质量为214.4克;④通过计算确定红色粉末的组成.
根据上述实验,回答下列问题:
Ⅰ.实验开始时,先通CO后称量B装置的总质量,再加热,实验目的是
A.排尽装置内空气,防止加热发生爆炸
B.防止装置内的空气影响测量结果
C.防止液体倒流到硬质玻璃管中
Ⅱ.C装置的作用是
Ⅲ.为防止实验中尾气对大气的污染,可以对尾气进行收集,现提供水槽和集气瓶,还需一种仪器是
Ⅳ.请你根据以上数据通过计算,得出红色粉末组成是
Ⅴ.不改变装置和药品,你还可以通过测定
【交流反思】小红认为红色粉中的铜,有一部分可能是C与Cu2O在高温下反应生成的,写出反应的化学方程式:
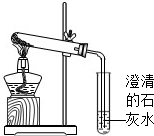 由C、CuO、Fe三种物质组成的混合物,放在试管中,如图所示高温加热.当观祭到澄清石灰水变浑浊时,停止加热,密封冷却至室温,然后往加热后的试管中加入稀硫酸,观察到有气泡冒出,且红色物质明显增加.请根据这些信息,推断红色物质产生和增加的可能原因(用化学方程式表示)
由C、CuO、Fe三种物质组成的混合物,放在试管中,如图所示高温加热.当观祭到澄清石灰水变浑浊时,停止加热,密封冷却至室温,然后往加热后的试管中加入稀硫酸,观察到有气泡冒出,且红色物质明显增加.请根据这些信息,推断红色物质产生和增加的可能原因(用化学方程式表示)