题目内容
【题目】为提高实验探究能力,某化学兴趣小组的同学在老师的指导下,对一瓶久置出现变质硬化的氢氧化钙固体进行如下探究活动。
【探究活动一】试验硬化的氢氧化钙样品是否完全变质
(1)用化学方程式表示氢氧化钙变质的原因: 。
(2)检验氢氧化钙样品是否完全变质,进行如下实验:
实验步骤 | 实验现象 | 实验结论 |
取氢氧化钙样品少量,研细后加适量蒸馏水 充分混合后静置, | 该样品还含有氢氧化钙 |
【探究活动二】测定样品中含有的变质固体(以下用R表示)的质量分数
取3克部分变质的氢氧化钙样品与足量的稀盐酸反应,测量生成气体的体积(气体不溶于植物油),从而计算出样品中R的质量,便可求出样品中R的质量分数。实验装置(气密性良好)如图1所示。

(3)将稀盐酸滴入样品中,产生气体的化学方程式为 ,反应一段时间后,当观察到 (填实验现象),才停止滴加稀盐酸。
(4)实验中量筒的作用是 。
(5)实验结束后,量筒内进入水的体积如图2所示,其读数为 mL。已知在该实验条件下,生成气体的密度为2g·L-1,通过计算,样品中R的质量分数为 。
(6)上述图1所示实验装置和相关试剂,用来实验测定样品中R的质量分数是比较粗略的,请简要说明测定数据存在误差的原因: (写一个)。
【答案】(1)Ca(OH)2+CO2=H2O+CaCO3↓
(2)滴入几滴酚酞试液;酚酞试液变为红色
(3)CaCO3 + 2HCl=CaCl2 + CO2↑ + H2O;气泡不再产生
(4)测量排出的水的体积
(5)165;25%
(6)稀盐酸具有挥发性,产生的气体中可能混有氯化氢气体。
【解析】
试题分析:(1)氢氧化钙的变质是因为会与空气中的二氧化碳反应;
(2)氢氧化钙和碳酸钙的鉴别,可根据氢氧化钙具有碱性能使酚酞变红来鉴别;
(3)碳酸钙和稀盐酸反应有二氧化碳生成;为保证准确性,需将碳酸钙完全反应,不再有二氧化碳产生说明碳酸钙被完全反应;
(4)由图为测试排出的水的体积,间接的得到气体的体积
(5)由图读数,视线于凹液面最低处齐平,因此为165ml;m(CO2)=0.165L×2g·L-1=0.33g。
设碳酸钙的质量分数为x。
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 44
3g·x 3.3g
100/3g·x=44/3.3g x=25%
因此R-碳酸钙的质量分数为25%;
(6)测得的气体体积中的气体,含有杂质,如水蒸气、氯化氢等,会产生误差。

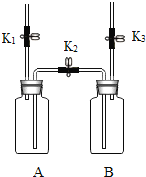
【题目】利用如图装置进行实验.实验前K1、K2、K3均已关闭.
装置 内容 | 【实验1】制备气体 | 【实验2】测定气体含量 |
| Ⅰ.打开K1,用注射器向盛有二氧化锰的A中注入过氧化氢溶液,直至液面浸没下端导管口 Ⅱ.在K1上方导管口收集气体 | Ⅰ.A(容积350mL)中为用排空气法收集的CO2,B中装满澄清石灰水.用注射器向A中注入15mL 澄清石灰水(足量,完全吸收CO2),充分反应. Ⅱ.打开K2和K3 |
(1)检查装置气密性:保持K1关闭,打开K2、K3,向B中加水至液面浸没下端导管口,用手捂住A瓶外壁,说明装置的左侧气密性良好的现象是 ;用同样原理可以检查装置另一侧的气密性.
(2)实验1中,气体收集完毕后,在不拆卸装置的情况下,使A中未反应的过氧化氢溶液大部分转移到B中的操作是 .
(3)实验2中,打开K2和K3后所观察到的现象是 ,A中发生反应的化学方程式为 ;当B中液面不再变化时,测得B中减少了160mL水,则A中CO2的体积分数约为 %.