题目内容
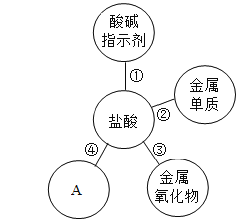
【题目】归纳是学习的重要方法,甲同学在复习所学盐酸的性质时,归纳出盐酸的四条化学性质(如图 所示,连线表示相互反应);乙同学为表示反应实质绘制如图。请根据下列图示和要求回答问题:
(1)图中为了验证性质①,甲同学将紫色石蕊试液滴加到盐酸溶液中,溶液变________色;图中A 所表示的物质类别可能是___________,请写出与其相应的一个化学反应方程式:______________。
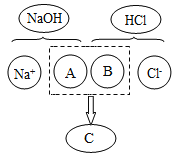
(2)如图描述了氢氧化钠溶液与盐酸反应的微观实质,图中A为______________,B为________,C为_________________。(填入的化学式或离子符号)
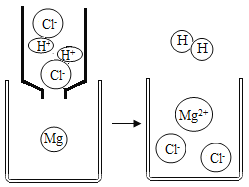
(3)如图是镁和盐酸反应过程的微观示意图,从微观角度看,该反应有效相互作用的微粒是 ________(写微粒符号,下同),产生的新微粒是_________。
【答案】红 碱(或者盐) NaOH+HCl═NaCl+H2O OH- H+ H2O Mg、H+ H2、Mg2+
【解析】
(1)盐酸显酸性,将紫色石蕊试液滴加到盐酸溶液中,溶液变红色;综合分析酸的化学性质可知:除去盐酸能与指示剂、金属氧化物、金属反应外还能与碱发生中和反应,氢氧化钠是碱,能和稀盐酸反应生成氯化钠和水,反应的化学方程式为:NaOH+HCl═NaCl+H2O.故填:红;碱;NaOH+HCl═NaCl+H2O。
(2)氢氧化钠是由钠离子和氢氧根离子构成,盐酸是由氢离子和氯离子构成,反应的微观实质是氢离子和氢氧根离子结合生成水分子,所以图中A、B、C处应填入的化学符号依次为OH-、H+、H2O;故填:OH-;H+;H2O;
(3)镁与稀盐酸反应生成氢气和氯化镁,从微观角度看,该反应有效相互作用的微粒是Mg、H+,产生的新微粒是H2、Mg2+;故填:Mg、H+;H2、Mg2+。