题目内容
【题目】(7分)根据下列数型图像回答:
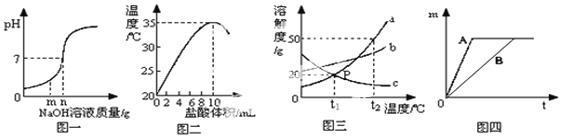
(1)图一是盐酸和氢氧化钠溶液进行中和反应时,反应过程中溶液的pH变化曲线,向盐酸中加入的氢氧化钠溶液质量为ng时,所得溶液中含有的离子为______(填离子符号) 。
(2)图二是20℃时,取10mL10%的NaOH溶液与烧杯中,逐滴加入10%的盐酸,随着盐酸的加入,烧杯中溶液温度与加入盐酸体积的变化关系。
①由图可知中和反应是_____反应(填“吸热”、“放热” );
②甲同学用氢氧化钠固体与稀盐酸反应也得到相同的结论,乙同学认为不严密,因为_______________。
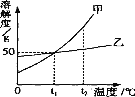
(3)图三是a、b、c三种物质的溶解度曲线。a与c的溶解度曲线相交于P点,据图回答:
①t1℃时,接近饱和的c物质溶液,在不改变溶液质量的条件下,可用________的方法达到饱和状态。
②当t2℃时,150g a物质饱和溶液降温到t1℃时,可析出______a物质。
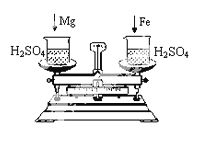
(4)下图托盘天平两边是等质量的铁和镁 分别跟等质量等浓度的稀硫酸反应, 反应的时间t与生成氢气质量m的 变化关系如图四。试回答:从开始反应到不在产生气体为止,天平指针偏转情况是____________
【答案】(1)Na+ Cl-
(2)①放热 ②氢氧化钠固体溶于水也放出热量
(3)①升温 ②30
(4)先向右偏,后平衡
【解析】
试题分析:(1)根据反应后溶液的pH变化曲线,当向盐酸中加入的氢氧化钠溶液质量为ng时,溶液的PH=7,即两者恰好完全反应,故所得溶液中含有的离子为Na+ Cl-
(2)①由图可知,随着盐酸的不断把加入,温度不断升高,故中和反应是放热反应;②甲同学用氢氧化钠固体与稀盐酸反应也得到相同的结论,乙同学认为不严密,因为:氢氧化钠固体溶于水也放出热量
(3)①根据溶解度曲线可知,c物质的溶解度随温度的升高而降低,故t1℃时,接近饱和的c物质溶液,在不改变溶液质量的条件下,可用升温的方法达到饱和状态;
②根据溶解度曲线可知,当t2℃时,a物质的溶解度为50g,故150g a物质饱和溶液中溶质50g,溶剂水100g,而降温到t1℃时,a物质的溶解度为20g,故可析出a物质质量=50g-20g=30g
(4)由于金属镁的活动性比铁强,故镁与稀硫酸反应的速率更快,反应刚开始时,产生氢气更多,根据图示可知,最终产生的氢气质量相等,故从开始反应到不在产生气体为止,天平指针偏转情况是:先向右偏,后平衡