题目内容
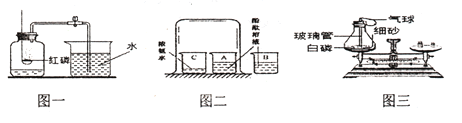
【题目】某同学设计了测定空气中氧气含量的实验,实验装置如图。该同学的实验步骤如下:①将图中的集气瓶分为5等份,并作好标记。②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞。③充分反应后,待集气瓶冷却至室温,打开止水夹。
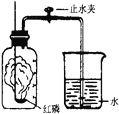
请回答下列问题:
(1)该实验中红磷需稍过量,目的是_____________。
(2)步骤③中打开止水夹后观察到的现象是___________,由此可得出空气中氧气的体积分数约为__________。
(3)该实验可推论出氮气_____(填“易”或“难”)溶于水和其化学性质_____的结论。
【答案】确保集气瓶内的氧气消耗尽 烧杯中的水倒流入集气瓶,液面上升至一等分刻度处 五分之一 难 不活泼
【解析】
(1)实验的目的是测定空气中氧气含量,原理是消耗氧气使装置内外产生压强差,水被吸入占据氧气的空间,从而达到测定氧气的目的,红磷过量,可使集气瓶中的氧气完全消耗;
(2)红磷与氧气反应,生成了五氧化二磷固体,所以会导致集气瓶内压强减小,水被压入集气瓶,进入的水量正好占据集气瓶内氧气的空间,约为集气瓶中气体体积的五分之一;据实验现象可得出空气中氧气的体积分数约为五分之一;
(3)剩余的气体主要是氮气,水进入瓶内占五分之一,不再继续进入说明氮气不能与红磷反应,也不能溶于水或与水反应;
故答案为:
(1)确保集气瓶内的氧气消耗尽;
(2)烧杯中的水倒流入集气瓶,液面上升至一等分刻度处;五分之一;
(3)难;不活泼。

【题目】老师从实验桌上拿出两瓶常用的但标签已经模糊不清的试剂, 分别是固体和液体, 他取少量试剂在试管中混合,立即产生一种无色气体。我们对此气体展开了一系列探究:
(1)①此气体是什么物质? 验证它的实验方案如下:
猜想 | 验证猜想的实验步骤 | 现象及结论 |
我认为此气体可能是_____ | _____ | _____ |
产生此气体的一个化学方程式是_____ | ||
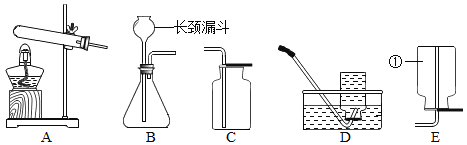
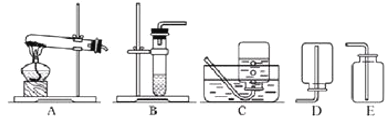
②我想制取该气体, 发生装置将选取下图中的_____(填序号, 以下同), 收集装置选取_____。
③如果用下图所示装置收集我猜想的气体, 我认为气体应从_____端(填“a”或“b”)导入.
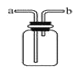
(2)我猜想无色气体还可能是另外一种气体, 产生它的其中一个化学方程式是_____;收集装置可采用上图中的_____(填序号).
【题目】某化学兴趣小组的同学需要制取一瓶氧气,请与他们一起进行实验之旅
(选择药品)小组同学查阅文献资料,获得了下列信息:过氧化氢、氯酸钾、高锰酸钾等在一定的条件下分解都可以产生氧气。其中过氧化氢溶液价格最低,常温时,在二氧化锰的催化作用下能够迅速分解放出氧气,该过程无副产物;氯酸钾固体价格较高,分解较困难,且常伴有副产物;高锰酸钾固体价格较高,加热即可快速分解。
(1)经讨论,过氧化氢、氯酸钾、高锰酸钾都能产生氧气,是因为______________ (填序号)
①三种方法所需仪器相同 ②反应都需要加热 ③都利用含氧元素化合物分解达到目的
(2)在选择制氧气的原料时,除了要含有所需的元素外,往往还需要考虑_______________等因素(填一条即可)
(明确原理)经过比较,同学们选择过氧化氢作为实验室制取氧气的原料,所发生化学反应的符号表达式为____________。
(选择装置)根据下列实验装置图,请回答问题。
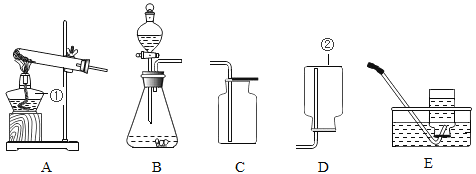
(1)写出上图中标有序号的仪器名称:①_____;②_____。
(2)实验室制取气体时,组装好仪器后,应先___,再添加药品。
(3)实验室用石灰石和稀盐酸制取二氧化碳时,应选用的发生装置是____(选填装置序号)。
(4)利用排空气发收集气体时导管口要接近集气瓶底部,其目的是_________。
(5)因为氧气不易溶于水,所以可以利用装置______(选填装置序号)收集。
(实验方法)“化学反应条件的控制是实验的灵魂”。化学兴小组的同学在老师指导下,进行了“影响过氧化氢溶液分解因素”的探究实验。下表是该小组探究影响过氧化氢分解速率的因素的相关实验数据。请你分析回答:
实验序号 | H2O2溶 液浓度% | H2O2溶液体积/mL | 温度℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 17 |
② | 15 | 1 | 20 | 0.1 | 4 | 67 |
③ | 30 | 5 | 35 | 2 | 49 | |
④ | 30 | 5 | 55 | 2 | 11 |
(1)通过实验①和②对比可知,化学反应速率与____________有关;
(2)从实验______和______对比可知,化学反应速率与温度的关系是:__________。