题目内容
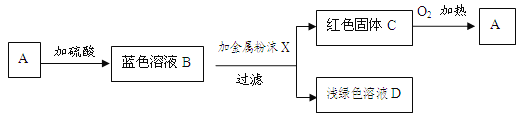
【题目】乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属。乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体。
【提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二: ;猜想三:Ca(OH)2,他的依据是 。
【交流反思】经过同学们交流讨论,认为猜想一不成立。否定猜想一的理由是: 。
【进行实验】
实验操作 | 实验现象 | 实验结论 |
取少量白色固体放入试管中,滴加稀盐酸。 | 。 | 猜想二不成立:不是CaCO3。 |
取少量白色固体加入到水中,取上层清液, 。 | 。 | 猜想三成立:白色固体是Ca(OH)2 |
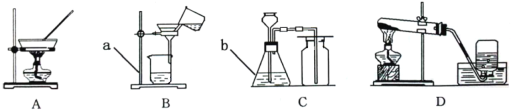
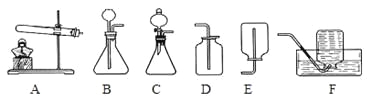
【拓展应用】已知碳化钙与水反应非常剧烈,乙炔的密度比空气略小,难溶于水。实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装置是(填图中装置序号) 。
【答案】:【做出猜想】CaCO3 质量守恒定律
【交流反思】CaO可以与水反应
【进行实验】
实验操作 | 实验现象 | 实验结论 |
没有气泡产生 | ||
滴加无色酚酞试液(或向其中通入CO2) | 溶液变红色(或溶液变浑浊) |
【拓展应用】C、F
【解析】试题分析:【做出猜想】根据质量守恒定律,反应前后的元素种类不变,故猜想二:CaCO3
【交流反思】猜想一不成立的理由:CaO可以与水反应
【进行实验】要来探究白色固体到底是CaCO3还是Ca(OH)2,应抓住这两种物质的化学性质的不同点,CaCO3能与盐酸反应产生二氧化碳气体,故取少量白色固体放入试管中,滴加稀盐酸,现象时没有气泡产生,则证明白色固体不是CaCO3,猜想二不成立;根据Ca(OH)2的水溶液显碱性,能使指示剂变色,或根据Ca(OH)2的水溶液能与二氧化碳反应,生成白色沉淀
【拓展应用】由于碳化钙与水反应非常剧烈,又要做到随时发生、随时停止,故应选择发生装置C,由于乙炔的密度比空气略小,难溶于水,则只能采用排水法收集,故选择的装置是C、F

 名校课堂系列答案
名校课堂系列答案【题目】在一个密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,下列说法正确的是( )
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 5 | 2 | 20 | 22 |
反应后质量/g | 待测 | 11 | 28 | 5 |
A. 该反应是化合反应 B. 甲是该反应的催化剂
C. 反应后甲的质量为0 D. 乙、丙变化的质量比为9:8