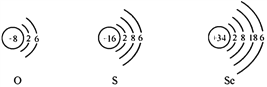
题目内容
【题目】有位同学设计了下列实验(装置及药品如图所示),回答:
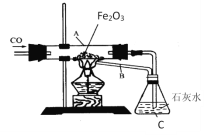
(1)玻璃管中观察到的现象是_______,发生反应的化学方程式为___________。
(2)在C处看到的现象是________,发生反应的化学方程式为________。
(3)本实验设计中,在B处所采取措施的目的是______,其优点是__________。
【答案】红色固体逐渐变为黑色固体Fe2O3+3CO![]() 2Fe+3CO2石灰水变浑浊CO2+Ca(OH)2=CaCO3↓+H2O进行尾气处理既处理了尾气,又节约了燃料
2Fe+3CO2石灰水变浑浊CO2+Ca(OH)2=CaCO3↓+H2O进行尾气处理既处理了尾气,又节约了燃料
【解析】
(1)一氧化碳和氧化铁在高温条件下生成铁和二氧化碳,故玻璃管中观察到的现象是红色固体逐渐变为黑色固体;该反应的化学方程式为Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(2)二氧化碳能和氢氧化钙反应生成碳酸钙白色沉淀和水,故在C处看到的现象是石灰水变浑浊;发生反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O;
(3)本实验设计中,在B处所采取措施的目的是进行尾气处理,防止一氧化碳污染空气;其优点是既处理了尾气,又节约了燃料。

【题目】竹子是“有节、中空、四季常绿”的植物(如图所示)。同学们对竹子中的气体成分展开了探究,测定其成分。
(提出猜想)猜想一:气体成分含有_____,猜想二:气体成分含有_____。
(1)收集竹子中的气体。
小华提出:将一节竹子浸没在水中,在竹子上钻孔,用排水法收集气体。
小刚提出:可用注射器从竹子中抽取气体。
大家认为两人的想法都可行,于是分为A、B两组,在相同条件下,A组采用小华的取气方法,B组采用小刚的取气方法,分别完成下面的实验。
(2)检验气体中是否含有二氧化碳气体。
实验步骤 | 实验现象 | 实验结论及解释 |
向所取得气体中加入: _____ | _____ | 有二氧化碳 |
(3)测定氧气含量。
(查阅资料)红磷的着火点为240℃,白磷的着火点为40℃。
(设计实验)同学们设计了如图所示的方案一和方案二来测定氧气含量。
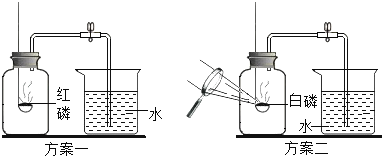
(进行实验)按上述两个方案进行多次实验。
(反思与评价)
a.实验中磷的量应为足量,原因是_____。
b.两个方案的实验测定结果不同,大家经讨论后一直认为方案_____(选填“一”或“二”)测定结果比较准确。原因是_____
c.经过A、B两组同学将收到的气体尽管都用比较准确的方案实验,但A的误差较大,小刚认为可能的原因是二氧化碳与水发生了化学反应,写出反应的化学方程式:_____。

【题目】(4分)莽草酸(化学式:C7H10O5)是制取抗“H1N1流感”药物“达菲”的原料。
请计算:(写出计算过程,并注意格式)
(1)莽草酸分子中C、H、O的质量比;
(2)莽草酸中氢元素的质量分数(精确到0.1%);
(3)174g莽草酸含氢元素的质量:
(4)对1岁以上的儿童推荐按照下列“体重一剂量表”服用“达菲”:
体重 | 小于等于15千克 | 15~23千克 | 23~40千克 | 大于40千克 |
每次用量 | 30mg | 45mg | 60mg | 60mg |
假如患病儿童的体重是35千克,在治疗过程中,需每天服用“达菲”胶囊(每颗胶囊含“达菲”60mg)2次,一个疗程5天,那么该患儿一个疗程共需服用多少颗?