题目内容
(2012?玄武区一模)以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.
Ⅰ.由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不符合电解要求,因此必须经过精制.如图是粗盐精制的流程:
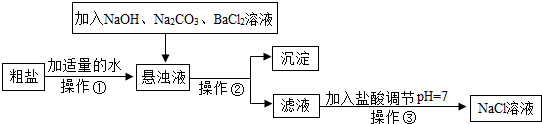
回答下列问题:
(1)操作②的名称是
(2)在悬浊液中加NaOH溶液、Na2CO3溶液、BaCl2溶液三种试剂的顺序合理的为
A.先加入NaOH,后加入Na2CO3,再加入BaCl2溶液
B.先加入NaOH,后加入BaCl2溶液,再加入Na2CO3
C.先加入BaCl2溶液,后加入NaOH,再加入Na2CO3
D.先加入BaCl2溶液,后加入Na2CO3,再加入NaOH
有同学提出用
Ⅱ.如图是电解食盐水制取氯气、氢氧化钠等产品的流程:

(3)在电解过程中,发生的反应为2NaCl+2H2O
Cl2↑+H2↑+2NaOH,电解后溶液的pH
(4)电解食盐水时,需防止Cl2和NaOH反应,因Cl2和NaOH溶液充分接触会生成NaClO、氯化钠、水,请写出Cl2和NaOH溶液反应的化学方程式
(5)该流程中可以循环利用的物质是
(6)若取100g的溶质质量分数为25%的氯化钠溶液进行电解,一段时间后停止通电,生成氯气的质量7.1g.请计算:生成氢气的质量为多少克?反应后溶液中NaOH的质量分数是多少?(写出计算过程,计算结果精确到0.1%)
(7)若使(6)中电解后的溶液恢复到原来状态,则需向溶液中加入适量的
Ⅰ.由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不符合电解要求,因此必须经过精制.如图是粗盐精制的流程:

回答下列问题:
(1)操作②的名称是
过滤
过滤
.(2)在悬浊液中加NaOH溶液、Na2CO3溶液、BaCl2溶液三种试剂的顺序合理的为
BCD
BCD
.A.先加入NaOH,后加入Na2CO3,再加入BaCl2溶液
B.先加入NaOH,后加入BaCl2溶液,再加入Na2CO3
C.先加入BaCl2溶液,后加入NaOH,再加入Na2CO3
D.先加入BaCl2溶液,后加入Na2CO3,再加入NaOH
有同学提出用
氢氧化钡
氢氧化钡
溶液代替BaCl2溶液可达到同样的目的.Ⅱ.如图是电解食盐水制取氯气、氢氧化钠等产品的流程:

(3)在电解过程中,发生的反应为2NaCl+2H2O
| ||
升高
升高
.(填“升高”、“不变”、“降低”)(4)电解食盐水时,需防止Cl2和NaOH反应,因Cl2和NaOH溶液充分接触会生成NaClO、氯化钠、水,请写出Cl2和NaOH溶液反应的化学方程式
2NaOH+Cl2═NaClO+NaCl+H2O
2NaOH+Cl2═NaClO+NaCl+H2O
.(5)该流程中可以循环利用的物质是
NaCl
NaCl
.(6)若取100g的溶质质量分数为25%的氯化钠溶液进行电解,一段时间后停止通电,生成氯气的质量7.1g.请计算:生成氢气的质量为多少克?反应后溶液中NaOH的质量分数是多少?(写出计算过程,计算结果精确到0.1%)
8.7%
8.7%
(7)若使(6)中电解后的溶液恢复到原来状态,则需向溶液中加入适量的
HCl或氯化氢
HCl或氯化氢
.分析:Ⅰ.(1)根据操作②后所得的为固体和液体,可以知道该操作为过滤;
(2)根据实验目的可以知道加入NaOH溶液、Na2CO3溶液、BaCl2溶液是为了除去MgCl2、CaCl2、Na2SO4等杂质,最后得到氯化钠,所以为了不引入新的杂质结合向滤液中加入的酸可以完成解答;
Ⅱ(3)根据反应后生成了氢氧化钠,而氢氧化钠呈碱性,所以可以判断溶液的酸碱性,并得出pH变化;
(4)根据题中所给物质结合质量守恒定律来完成该化学方程式的书写,注意配平;
(5)原材料为氯化钠,而反应也生成了氯化钠,所以可以判断氯化钠可以循环利用;
(6)根据电解水的反应的化学方程式,结合生成氯气的质量可以求算出生成的氢气及氢氧化钠的质量,进而可以求算出氢氧化钠溶液的质量分数;
(7)反应后生成的溶液由于含有氢氧化钠而呈碱性,所以要恢复原来的状态应该加入适量的盐酸,可以据此答题.
(2)根据实验目的可以知道加入NaOH溶液、Na2CO3溶液、BaCl2溶液是为了除去MgCl2、CaCl2、Na2SO4等杂质,最后得到氯化钠,所以为了不引入新的杂质结合向滤液中加入的酸可以完成解答;
Ⅱ(3)根据反应后生成了氢氧化钠,而氢氧化钠呈碱性,所以可以判断溶液的酸碱性,并得出pH变化;
(4)根据题中所给物质结合质量守恒定律来完成该化学方程式的书写,注意配平;
(5)原材料为氯化钠,而反应也生成了氯化钠,所以可以判断氯化钠可以循环利用;
(6)根据电解水的反应的化学方程式,结合生成氯气的质量可以求算出生成的氢气及氢氧化钠的质量,进而可以求算出氢氧化钠溶液的质量分数;
(7)反应后生成的溶液由于含有氢氧化钠而呈碱性,所以要恢复原来的状态应该加入适量的盐酸,可以据此答题.
解答:解:Ⅰ(1)根据操作②后所得的为固体和液体,可以知道操作②为过滤;
(2)根据实验目的可以知道加入NaOH溶液可以将镁离子除去,加入Na2CO3溶液可以除去钙离子,加入BaCl2溶液可以除去硫酸根离子,同时不能引入新的杂质,所以:
A、先加氢氧化钠溶液,可以除去镁离子,加入碳酸钠溶液可以除去钙离子,最后加入氯化钡溶液,此时多余的钡离子不能被除去,引入的钡离子,故A不能达到目的;
B、先加氢氧化钠溶液,可以除去镁离子,再加入氯化钡,除去硫酸根离子,再加碳酸钠,能把钙离子除去,同时除去了可能含有的钡离子,没有引入新的杂质,故B方法正确;
C、先加氯化钡,除去硫酸根,再加氢氧化钠,除去镁离子,最后加碳酸钠,除去钙离子和多余的钡离子,没有引入新的杂质,故C方法正确;
D、先加氯化钡,除去硫酸根,再加碳酸钠,除去多余的钡离子和钙离子,最后加氢氧化钠,除去镁离子,没有引入新的杂质,故D方法正确.
故选A.
氢氧化钡也可以和硫酸钠反应生成硫酸钡沉淀而除去,同时经酸化后氢氧根转化为水,也没有引入新的杂质,故本实验中用氢氧化钡溶液来代替氯化钡同样能够达到目的;
Ⅱ(3)由题意可知在电解过程中,发生的反应为2NaCl+2H2O
Cl2↑+H2↑+2NaOH,由于生成了氢氧化钠而使溶液变为碱性,所以电解后溶液的pH值要升高;
(4)根据题给的条件可以知道Cl2和NaOH溶液充分接触会生成NaClO、氯化钠、水,故可以写出该反应的化学方程式为:2NaOH+Cl2═NaClO+NaCl+H2O;
(5)原材料为氯化钠,而反应也生成了氯化钠,所以可以判断氯化钠可以循环利用;
(6)设:生成氢气的质量为x,氢氧化钠的质量为y
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
71 2 80
7.1g x y
=
x=0.2g
=
y=8 g
所以反应后所得溶液中溶质质量分数:
×100%=8.7%;
答:生成氢气的质量为0.2克,反应后溶液中NaOH的质量分数是8.7%.
(7)反应后生成的溶液由于含有氢氧化钠而呈碱性,所以要恢复原来的状态应该加入适量的盐酸.
故答案为:Ⅰ.(1)过滤;
(2)B、C、D;Ba(OH)2;
Ⅱ.(3)升高;
(4)2NaOH+Cl2═NaClO+NaCl+H2O;
(5)NaCl;
(6)0.2g;8.7%;
(7)HCl或氯化氢.
(2)根据实验目的可以知道加入NaOH溶液可以将镁离子除去,加入Na2CO3溶液可以除去钙离子,加入BaCl2溶液可以除去硫酸根离子,同时不能引入新的杂质,所以:
A、先加氢氧化钠溶液,可以除去镁离子,加入碳酸钠溶液可以除去钙离子,最后加入氯化钡溶液,此时多余的钡离子不能被除去,引入的钡离子,故A不能达到目的;
B、先加氢氧化钠溶液,可以除去镁离子,再加入氯化钡,除去硫酸根离子,再加碳酸钠,能把钙离子除去,同时除去了可能含有的钡离子,没有引入新的杂质,故B方法正确;
C、先加氯化钡,除去硫酸根,再加氢氧化钠,除去镁离子,最后加碳酸钠,除去钙离子和多余的钡离子,没有引入新的杂质,故C方法正确;
D、先加氯化钡,除去硫酸根,再加碳酸钠,除去多余的钡离子和钙离子,最后加氢氧化钠,除去镁离子,没有引入新的杂质,故D方法正确.
故选A.
氢氧化钡也可以和硫酸钠反应生成硫酸钡沉淀而除去,同时经酸化后氢氧根转化为水,也没有引入新的杂质,故本实验中用氢氧化钡溶液来代替氯化钡同样能够达到目的;
Ⅱ(3)由题意可知在电解过程中,发生的反应为2NaCl+2H2O
| ||
(4)根据题给的条件可以知道Cl2和NaOH溶液充分接触会生成NaClO、氯化钠、水,故可以写出该反应的化学方程式为:2NaOH+Cl2═NaClO+NaCl+H2O;
(5)原材料为氯化钠,而反应也生成了氯化钠,所以可以判断氯化钠可以循环利用;
(6)设:生成氢气的质量为x,氢氧化钠的质量为y
2NaCl+2H2O
| ||
71 2 80
7.1g x y
| 71 |
| 2 |
| 7.1g |
| X |
| 71 |
| 80 |
| 7.1g |
| y |
所以反应后所得溶液中溶质质量分数:
| 8g |
| 100g-7.1g-0.2g |
答:生成氢气的质量为0.2克,反应后溶液中NaOH的质量分数是8.7%.
(7)反应后生成的溶液由于含有氢氧化钠而呈碱性,所以要恢复原来的状态应该加入适量的盐酸.
故答案为:Ⅰ.(1)过滤;
(2)B、C、D;Ba(OH)2;
Ⅱ.(3)升高;
(4)2NaOH+Cl2═NaClO+NaCl+H2O;
(5)NaCl;
(6)0.2g;8.7%;
(7)HCl或氯化氢.
点评:做推断题时要充分利用所给的信息,结合自己已学过的知识,进行有依据性的推测.在除去杂质时要注意通过离子间的反应把离子转化为沉淀和气体除去,但要注意加入试剂的量,最后不能引入新的杂质.

练习册系列答案
相关题目

