题目内容
化学实验课上,同学们利用下列实验探究碱的化学性质:

(1)甲实验中加入指示剂酚酞的目的是 ;
(2)丙实验中反应的化学方程式为 ;
(3)实验结束后,同学们将废液倒入同一只废液缸中,发现废液显红色,小刚脱口而出“废液中含有氢氧化钠”,小刚的说法正确吗?说明理由 。
于是同学们对废液的成分展开讨论和探究:
【猜想与假设】通过分析上述实验,同学们猜想:废液中除酚酞外还一定含有 ,可能含有 中的一种或几种(填一种组合)。
【实验验证】同学们取一定量的废液过滤后,向滤液中逐滴加入稀盐酸,根据反应现象绘制了如图所示的示意图。
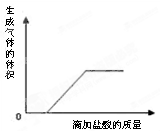
【结论】分析图象得出可能存在的物质中,含有 ;
没有 。

(1)甲实验中加入指示剂酚酞的目的是 ;
(2)丙实验中反应的化学方程式为 ;
(3)实验结束后,同学们将废液倒入同一只废液缸中,发现废液显红色,小刚脱口而出“废液中含有氢氧化钠”,小刚的说法正确吗?说明理由 。
于是同学们对废液的成分展开讨论和探究:
【猜想与假设】通过分析上述实验,同学们猜想:废液中除酚酞外还一定含有 ,可能含有 中的一种或几种(填一种组合)。
【实验验证】同学们取一定量的废液过滤后,向滤液中逐滴加入稀盐酸,根据反应现象绘制了如图所示的示意图。

【结论】分析图象得出可能存在的物质中,含有 ;
没有 。
(1)判断该反应是否恰好反应完;
(2)Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;
(3)不对,碳酸钠可能剩余,而碳酸钠溶液也呈碱性
【猜想与假设】氯化钠; ①氢氧化钠、碳酸钠②氢氧化钠、氢氧化钙、氯化钙③氢氧化钙、氯化钙。
【结论】:碳酸钠、氢氧化钠; 氢氧化钙、氯化钙。
(2)Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;
(3)不对,碳酸钠可能剩余,而碳酸钠溶液也呈碱性
【猜想与假设】氯化钠; ①氢氧化钠、碳酸钠②氢氧化钠、氢氧化钙、氯化钙③氢氧化钙、氯化钙。
【结论】:碳酸钠、氢氧化钠; 氢氧化钙、氯化钙。
(1)稀盐酸和氢氧化钠反应无明显现象,所以需要借助酚酞来判断反应是否恰好完全反应。
(2)丙实验中是碳酸钠和氢氧化钙反应,该反应的化学方程式为Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
(3)酚酞遇到碱性溶液都可以变红,所以他变红了只能说明溶液显碱性,碳酸钠也显碱性,故碳酸钠剩余的话也可能使溶液显碱性。
【猜想与假设】:盐酸和氢氧化钠反应生成了氯化钠,而氯化钠不会和这里的其他物质反应,故剩余溶液中一定含有氯化钠,而其他物质都可能有剩余,也就都可能有,但是要注意碳酸钠和氢氧化钙、氯化钙能反应,他们不能同时剩余,故可能含有的物质有三种可能,①氢氧化钠、碳酸钠②氢氧化钠、氢氧化钙、氯化钙③氢氧化钙、氯化钙。
【结论】由图像可以看出,刚开始没有产生气体,说明溶液中纯在着氢氧化钠或氢氧化钙,但是后面又产生了气体,说明溶液中肯定有碳酸钠,碳酸钠能与氢氧化钙、氯化钙反应,故有碳酸钠了,就不能有氢氧化钙、氯化钙了,那溶液中纯在的碱就只能是氢氧化钠了,故最终我们可以确定溶液中一定含有碳酸钠、氢氧化钠, 一定不含氢氧化钙、氯化钙。
(2)丙实验中是碳酸钠和氢氧化钙反应,该反应的化学方程式为Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
(3)酚酞遇到碱性溶液都可以变红,所以他变红了只能说明溶液显碱性,碳酸钠也显碱性,故碳酸钠剩余的话也可能使溶液显碱性。
【猜想与假设】:盐酸和氢氧化钠反应生成了氯化钠,而氯化钠不会和这里的其他物质反应,故剩余溶液中一定含有氯化钠,而其他物质都可能有剩余,也就都可能有,但是要注意碳酸钠和氢氧化钙、氯化钙能反应,他们不能同时剩余,故可能含有的物质有三种可能,①氢氧化钠、碳酸钠②氢氧化钠、氢氧化钙、氯化钙③氢氧化钙、氯化钙。
【结论】由图像可以看出,刚开始没有产生气体,说明溶液中纯在着氢氧化钠或氢氧化钙,但是后面又产生了气体,说明溶液中肯定有碳酸钠,碳酸钠能与氢氧化钙、氯化钙反应,故有碳酸钠了,就不能有氢氧化钙、氯化钙了,那溶液中纯在的碱就只能是氢氧化钠了,故最终我们可以确定溶液中一定含有碳酸钠、氢氧化钠, 一定不含氢氧化钙、氯化钙。

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目






