题目内容
【题目】一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种,为确定其组成,某同学设计了如下实验方案:

下列判断正确的是( )
A.蓝色溶液B中阳离子只有Cu2+
B.无色溶液A中一定有NaOH
C.原固体粉末一定有NaCl
D.原固体粉末一定有CaCO3、NaOH、NaNO3、CuCl2和Ca(NO3)2
【答案】B
【解析】
试题分析:根据“一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种”,结合图框,则推测铜离子在溶液中显蓝色,NaOH和CuCl2会生成氢氧化铜沉淀,而氢氧化铜沉淀与稀硝酸反应生成硝酸铜溶液;CaCO3和硝酸反应会生成气体,则蓝色溶液B中有硝酸铜、硝酸钙、硝酸钠、稀硝酸,而原固体粉末一定有CaCO3、NaOH、CuCl2和Ca(NO3)2,无法确定是否含有NaCl;NaNO3。故选:B。

 阅读快车系列答案
阅读快车系列答案【题目】某化学兴趣小组的同学在学习九年级《化学》下册中的资料卡片“石笋和钟乳石的形成”时,发现难溶于水的碳酸钙当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O═Ca(HCO3)2。
【提出问题】向NaOH溶液里通入一定量CO2,反应后的溶质组成是什么?
【查阅资料】
(1)在NaOH溶液中通入少量CO2反应的化学方程式:_________________。
(2)在NaOH溶液中通入过量CO2,反应的化学方程式为:
2NaOH+CO2+H2O═2NaHCO3.
(3)碳酸氢钠溶液呈碱性.
【提出猜想】猜想一:溶质为Na2CO3; 猜想二:溶质为NaHCO3;
猜想三:溶质为___________________(填化学式).
【设计实验】
实验步骤 | 实验现象 | 实验结论 |
(1)取反应后溶液少许于试管中,向其中滴加几滴酚酞 | 酚酞变红色 | 该溶液显碱性 |
(2)另取反应后溶液少许于试管中,向其中滴加过量的CaCl2溶液 | 有______________________生成。 | 猜想二不成立 |
(3)取步骤(2)中的上层清液,滴入稀盐酸 | 有气泡冒出,化学方程式为 _________________________ | 猜想一不成立 |
【得出结论】猜想三成立.
【讨论交流】有同学提出,实验步骤(1)是多余的,理由是________________。
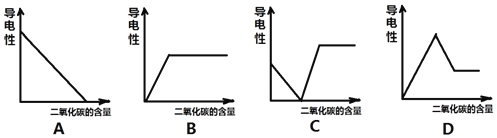
【反思应用】同学们回忆起实验室检验二氧化碳的情景,如果向澄清石灰水中不断通入二氧化碳,会看到___________________________________现象,此时下列哪一种曲线能反映出该溶液的导电性与二氧化碳的量之间的关系(________)