题目内容
【题目】某化学兴趣小组的同学在学习九年级《化学》下册中的资料卡片“石笋和钟乳石的形成”时,发现难溶于水的碳酸钙当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O═Ca(HCO3)2。
【提出问题】向NaOH溶液里通入一定量CO2,反应后的溶质组成是什么?
【查阅资料】
(1)在NaOH溶液中通入少量CO2反应的化学方程式:_________________。
(2)在NaOH溶液中通入过量CO2,反应的化学方程式为:
2NaOH+CO2+H2O═2NaHCO3.
(3)碳酸氢钠溶液呈碱性.
【提出猜想】猜想一:溶质为Na2CO3; 猜想二:溶质为NaHCO3;
猜想三:溶质为___________________(填化学式).
【设计实验】
实验步骤 | 实验现象 | 实验结论 |
(1)取反应后溶液少许于试管中,向其中滴加几滴酚酞 | 酚酞变红色 | 该溶液显碱性 |
(2)另取反应后溶液少许于试管中,向其中滴加过量的CaCl2溶液 | 有______________________生成。 | 猜想二不成立 |
(3)取步骤(2)中的上层清液,滴入稀盐酸 | 有气泡冒出,化学方程式为 _________________________ | 猜想一不成立 |
【得出结论】猜想三成立.
【讨论交流】有同学提出,实验步骤(1)是多余的,理由是________________。
【反思应用】同学们回忆起实验室检验二氧化碳的情景,如果向澄清石灰水中不断通入二氧化碳,会看到___________________________________现象,此时下列哪一种曲线能反映出该溶液的导电性与二氧化碳的量之间的关系(________)
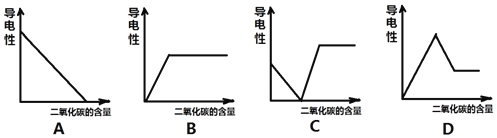
【答案】 CO2+2NaOH=Na2CO3+H2O Na2CO3和NaHCO3 白色沉淀 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 碳酸氢钠和碳酸钠都是碱性的 溶液由澄清变浑浊 又由浑浊变澄清 C
【解析】【查阅资料】
(1)在NaOH溶液中通入少量CO2反应的化学方程式是:CO2+2NaOH=Na2CO3+H2O (3)猜想三:溶质为Na2CO3和NaHCO3 【设计实验】(2)Na2CO3+ CaCl2= CaCO3↓+2 NaCl,NaHCO3与CaCl2溶液不反应。(3)在上步实验中,滴加过量的CaCl2溶液,已经除尽了Na2CO3,取步骤(2)中的上层清液,滴入稀盐酸有气泡冒出,说明含有NaHCO3,因为NaHCO3 + HCl == NaCl + H2O + CO2↑。【讨论交流】碳酸氢钠和碳酸钠都是碱性的,都能使酚酞溶液变红。【反思应用】CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,故向澄清石灰水中不断通入二氧化碳,会看到溶液由澄清变浑浊又由浑浊变澄清的现象。澄清石灰水能导电,碳酸钙不能导电,碳酸氢钙溶液能导电,故选C。