题目内容
【题目】科学家尝试通过多种途径减少CO2的排放,或将CO2转化为有用的物质。其中一种途径是利用NaOH溶液来“捕捉”CO2,并将CO2储存或利用,反应流程如图所示。
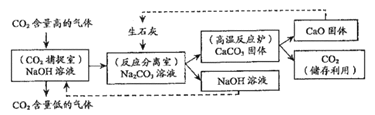
(1)反应分离室中分离物质的操作是_____________。
(2)上述反应流程中,可循环利用的物质是____________。
(3)若反应分离室中有溶质质量分数为10.6%的Na2CO3溶液100千克。求完全反应后,理论上可生成CaCO3的质量_____________(要求根据化学方程式计算)。
【答案】 过滤 NaOH和CaO 10kg
【解析】(1)反应分离室中将固体和液体分离,故是过滤;
(2)该反应流程中可循环再利用的是NaOH和CaO;
(3)100千克10.6%的Na2CO3溶液中碳酸钠的质量为100kg![]() =10.6kg,设可生成碳酸钙的质量为x
=10.6kg,设可生成碳酸钙的质量为x
Ca(OH)2+ Na2CO3=2 NaOH+ CaCO3 ↓
106 100
10.6kg x
![]() =
=![]() ,解得x=10kg。
,解得x=10kg。

练习册系列答案
相关题目
【题目】请从A或B两题中任选一个作答,若两题均作答,按A计分。

A | B |
实验室用高锰酸钾制取氧气的化学方程式是_____。 用装置A、E制取氧气应该等到_______________时再收集。 | (1)实验室制取二氧化碳的化学方程式是_____。 (2)通常用装置C收集二氧化碳的理由是___________________ 。 |