题目内容
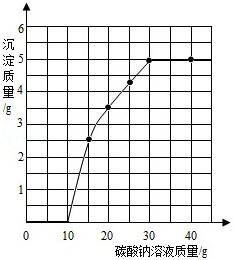
请根据下图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题: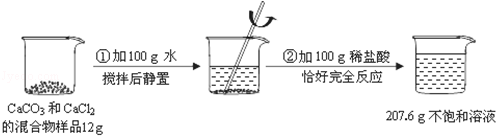
(1)该反应产生的气体质量为 g。
(2)实验所用稀盐酸的溶质的质量分数为 。
(3)计算原混合物样品中CaCl2的质量(写出计算过程)?
(1)4.4;(2)7.3%;(3)答:原混合物样品中CaCl2的质量为2g
解析试题分析:(1)根据图中信息可以知道,反应前加入的物质的总质量为:12g+100g+100g=212g,而反应后剩余物质的总质量为207.6g,根据质量守恒定律可以知道物质减少的质量为生成二氧化碳的质量;
(2)利用生成的二氧化碳质量可以据化学方程式求出盐酸的质量分数;
(3)根据二氧化碳的质量结合化学方程式可以求算出碳酸钙的质量,进而可以求出氯化钙的质量.
解(1)反应中生成CO2的质量为:12g+100g+100g﹣207.6g=4.4g;
(2)设盐酸的质量分数为x,反应的碳酸钙质量是y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
y 100g×x 4.4g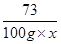 =
=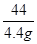 =
=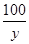
解得x=7.3%、y=10g
(3)由于混合物中碳酸钙的质量是10g,所以原混合物样品中CaCl2的质量为:12g﹣10g=2g
考点:考查根据化学反应方程式的计算;有关溶质质量分数的简单计算

 阅读快车系列答案
阅读快车系列答案(本题包括1小题,共12分)
27.(11分)四硫化钠(Na2S4)固体可替代红磷测定空气中氧气的体积分数,反应原理为:2 Na2S4 + O2 + 2H2O =" 8S↓+" 4 NaOH。
【实验资料】
①四硫化钠(Na2S4)的相对分子质量为 ,其中硫元素的质量分数为 (结果精确到0.1%)。
②四硫化钠受热时,会与空气中的水蒸气反应,生成少量有毒气体硫化氢。
③NaOH溶液呈碱性,可吸收硫化氢、二氧化碳、二氧化硫等酸性气体
④硫代硫酸钠(Na2S2O3)可溶于水,常温下与NaOH溶液不反应。
【实验过程】
①取碳酸钠、 硫粉混合后置于试管中,加热(如图1所示,夹持装置已略去),制得Na2S4,反应为4Na2CO3 + 12S + X  2 Na2S4+ 2 Na2S2O3 + 4CO2,X 的化学式为 ,蘸有浓NaOH 溶液的棉花的作用是 。
2 Na2S4+ 2 Na2S2O3 + 4CO2,X 的化学式为 ,蘸有浓NaOH 溶液的棉花的作用是 。 
②冷却后,取下棉花,放置一段时间,再向该试管中加入10ml水,迅速塞紧橡胶塞,充分振荡,测量液面至橡胶塞下沿的距离,记录数据h1(如图2所示)
③将该试管插入水中(如图3所求),取下橡胶塞,观察到
,塞紧橡胶塞。将试管取出,倒过来,测量液面至橡胶塞下沿的距离,记录数据h2,理论上h1:h2=
④按照①~③再重复实验2次.3次实验数据如下表所示。
| | 第1次 | 第2次 | 第3次 |
| h1/cm | 11.2 | 11.4 | 11.6 |
| h2/cm | 8.9 | 9.1 | 9.2 |
【解释与结论】根据第1次实验数据,计算空气中氧气的体积分数为 (结果精确到0.1%)。
【反思与评价】(1)若实验过程②中,取下棉花后,未放置一段时间即进行后续操作,会影响测定结果,请说明有何影响,并阐述理由: 。(2分)
(2)若要保证实验的效果,至少需要生成四硫化钠(Na2S4)0.174g ,则理论上实验时至少取碳酸钠粉末 克?写出计算过程(2分)
 2CO2+3H2O,现有100g质量分数为92%的乙醇溶液在空气中完全燃烧产生二氧化碳的质量为多少克?
2CO2+3H2O,现有100g质量分数为92%的乙醇溶液在空气中完全燃烧产生二氧化碳的质量为多少克?