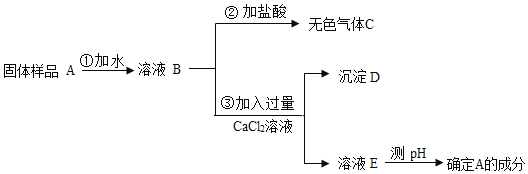
题目内容
【题目】化学兴趣小组的同学用稀盐酸(浓度为12.3%)与块状石灰石制取CO2,并完成CO2的性质探究,小强同学完成实验后,观察到发生装置中还存在块状石灰石,但已无气泡产生,他认为废液中已无盐酸。老师告诫同学们不要急于下结论,让实验说话。
[问题引入]小强同学用pH试纸测得废液的pH=2,证明溶液显_______________性,可得到的结论是_________________。小林同学接着发问:剩下的块状石灰石中是否含有CaCO3呢?带着疑问,小林同学取出废液中的石灰石,洗净放入试管中,向其中滴加浓度为12.3%的稀盐酸,立即产生大量气泡,可得到的结论是_________________。
[提出问题]发生装置中盐酸与石灰石都有剩余,为何观察不到反应现象呢?
[猜想与假设]小强猜想:石灰石的颗粒太大,与盐酸接触不充分,观察不到现象;小林猜想:盐酸浓度太低,观察不到现象。
[实验验证]为了验证猜想,老师及时向小强同学提供了纯净的粉末状碳酸钙,他取少量的粉末状碳酸钙于试管中,加入2mL废液,立即产生气泡。小林同学则是将废液中的石灰石洗净置于试管中,加入2 mL浓度为12. 3%的盐酸,也有气泡产生。
[实验结论]依据[实验验证]中的现象,发生装置中盐酸与石灰石共存,却观察不到气泡的原因是_________________。
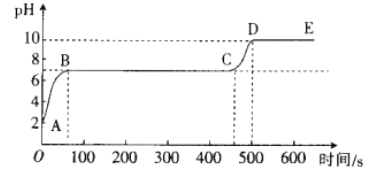
[拓展延伸]另取适量废液,向其中逐滴滴入碳酸钠溶液,并用pH数字探测仪连续监测,得到如图所示的曲线(pH为纵坐标,时间为横坐标)。
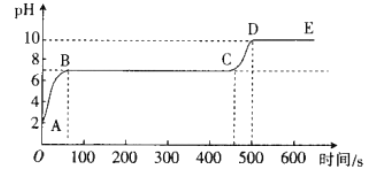
①写出BC段发生反应的化学方程式:_________________。
②CD段pH上升的原因是_________________。
【答案】酸 盐酸没有反应完 剩余的块状石灰石中还含有CaCO3 盐酸浓度太低,同时石灰石与盐酸接触不充分,造成反应速率过慢,观察不到明显的现象. ![]() 碳酸钠溶液过量,碳酸钠溶液显碱性
碳酸钠溶液过量,碳酸钠溶液显碱性
【解析】
[问题引入]
取废液,用pH试纸测得溶液pH=2,说明溶液显酸性,即盐酸没有反应完;取出废液中的石灰石,洗净放入试管中,向其中滴加浓度为12.3%的稀盐酸,立即产生大量气泡,可得到的结论是石灰石中仍含有碳酸钙;
[实验结论]
依据[实验验证]中的现象,发生装置中盐酸与石灰石共存,却观察不到气泡的原因是盐酸浓度太低,同时石灰石与盐酸接触不充分,造成反应速率过慢,观察不到明显的现象;
[拓展延伸]
反应后的溶液中含有氯化钙和氯化氢,滴加碳酸钠溶液时,碳酸钠先与氯化氢反应生成氯化钠、水和二氧化碳,随着氯化氢的消耗,溶液的酸性减弱,pH增大,当pH=7时,氯化氢完全反应,然后碳酸钠再与氯化钙反应生成氯化钠和碳酸钙沉淀,此反应过程中,溶液呈中性,pH=7,当氯化钙完全反应后,继续滴加碳酸钠溶液,溶液呈碱性,pH大于7。
①BC段发生的反应是碳酸钠与氯化钙反应生成氯化钠和碳酸钙沉淀,反应的化学方程式Na2CO3+CaCl2=CaCO3↓+2NaCl;
②碳酸钠溶液呈碱性,CD段加入的碳酸钠溶液已经过量,不再参加反应,使溶液的碱性增强。所以加入Na2CO3溶液增多,pH升高。

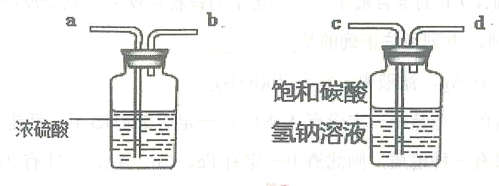
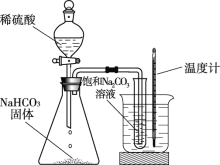
【题目】向饱和碳酸钠溶液中通入CO2会析出碳酸氢钠晶体而是溶液变浑浊,发生反应的化学方程式为Na2CO3 + CO2 + H2O = 2NaHCO3。某化学小组同学用下图装置探究影响碳酸氢钠晶体产生快慢的因素,结果如下表。下列判断不正确的是
序号 | 温度/℃ | CO流速 (个气泡/秒) | 出现浑浊 的时间 |
① | 25 | 5~8 | 5′17″ |
② | 40 | 5~8 | 3′48″ |
③ | 25 | 10~13 | 5′02″ |
④ | 25 | 2~5 | 5′40″ |
A. 锥形瓶中反应的化学方程式为2NaHCO3 + H2SO4 = Na2SO4 + H2O + CO2↑
B. ①②对比可知,其他条件相同时,温度越高,析出晶体越快
C. ③④对比可知,其他条件相同时,CO2流速越大,析出晶体越快
D. ①③对比可知,二氧化碳的流速是影响析出晶体快慢的主要因素