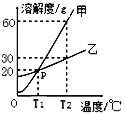
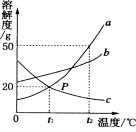
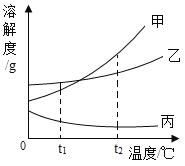
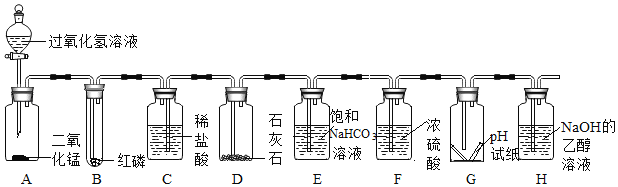
题目内容
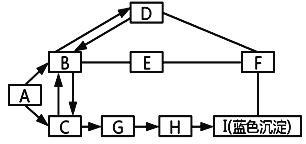
【题目】NaOH易与CO2反应而变质。小华看见实验台上有一瓶敞口放置的NaOH,对其成分进行探究,设计实验方案如图。
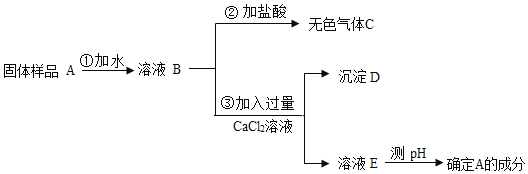
(提示:CaCl2溶液呈中性)
(1)NaOH变质反应的化学方程式为_____。
(2)图中,操作①的名称是_____。
(3)根据如图实验现象判断,该NaOH_____(填“未”或“已”)变质。
(4)操作③加入过量CaCl2溶液的目的是_____。
(5)若测得E的pH>7,则A的成分是_____(填化学式)
【答案】2NaOH+CO2=Na2CO3+H2O 溶解 已 检验并且除去碳酸钠 NaOH、Na2CO3
【解析】
(1)NaOH变质反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O。
(2)图中,操作①的名称是溶解。
(3)根据如图实验现象判断,加入盐酸产生气泡,是因为碳酸钠和盐酸反应生成了二氧化碳,该NaOH已变质。
(4)操作③加入过量CaCl2溶液的目的是检验并且除去碳酸钠。
(5)若测得E的pH>7,说明溶液中含有氢氧化钠,则A的成分是NaOH Na2CO3。
故填:2NaOH+CO2=Na2CO3+H2O;溶解;已;检验并且除去碳酸钠;NaOH Na2CO3。

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案【题目】生铁和钢都是由铁和碳组成的合金,生铁中碳的含量为2%~4.3%,钢中碳的含量为 0.03%~2%,为测定某种铁合金中碳的含量,小王同学取一定质量的合金样品盛放在烧杯中,并向其中逐滴加入稀盐酸至恰好完全反应,实验数据如下表所示:
烧杯质量 | 样品的质量 | 稀盐酸的质量 | 烧杯+剩余物的总质量 |
50g | 5.8g | 94.6g | 150.2g |
注:碳既不溶于水也不与稀盐酸发生反应。
请根据相关信息完成下列计算:
(1)恰好完全反应时,生成氢气的质量为____ g;
(2)样品中碳的质量分数 ____(计算结果保留到0.1%);
(3)反应后得到的溶液中溶质的质量分数____(计算结果保留到0.1%)。
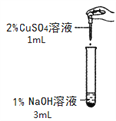
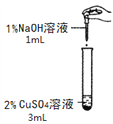
【题目】在一次化学实验中,两组同学都完成了硫酸铜溶液与氢氧化钠溶液反应的实验,但观察到了不同的实验现象。
【实验一】
实验组 | 甲组 | 乙组 |
实验操作 |
|
|
实验现象 | 产生蓝色沉淀 | 产生蓝绿色沉淀 |
⑴已知蓝色沉淀是氢氧化铜,写出生成蓝色沉淀的化学方程式______。
【提出问题】乙组产生的蓝绿色沉淀的成分是什么呢?
【查阅资料】
Ⅰ.碱式硫酸铜是绿色晶体,在水中溶解度极小,能溶于稀酸溶液。
Ⅱ.碱式硫酸铜的组成不固定,一般可用Cu2(OH)2SO4表示。
【猜想与假设】蓝绿色沉淀是碱式硫酸铜。
【实验二】
实验步骤 | 主要实验操作 | 现象及结论 |
① | 取乙组实验后的混合物过滤 | 得到蓝绿色沉淀 |
② | 取蓝绿色沉淀,用蒸馏水洗涤多次 | 无明显现象 |
③ | 向最后一次洗涤液中滴加BaCl2溶液 | 无沉淀产生 |
④ | 取洗涤后的蓝绿色沉淀于试管中,滴加稀盐酸 | 沉淀全部溶解,得到蓝绿色溶液 |
⑤ | 取少量蓝绿色溶液于试管中,滴加试剂X | 产生白色沉淀 |
实验结论:蓝绿色沉淀是碱式硫酸铜 | ||
【解释与结论】
⑵步骤③的实验目的是______。
⑶步骤④中的稀盐酸______(选填“能”或“不能”)用稀硫酸代替。
⑷步骤⑤中滴加的试剂X是______。
【反思与评价】
⑸甲组同学在本组实验的基础上进一步成下列实验:
①过滤,取蓝色沉淀于试管中;
②滴加______,沉淀颜色变为蓝绿色;
③重复实验二中的步骤①~⑤。
经实验验证,氢氧化铜也可以转化为碱式硫酸铜。此反应的化学方程式为______。
⑹乙组同学认为在自己组原有实验的基础上,继续滴加______,可以将碱式硫酸铜转变为氢氧化铜。通过实验,也验证了他们的猜想。
⑺为了确保氢氧化钠溶液和硫酸铜溶液反应生成氢氧化铜,实验的关键是______。