题目内容
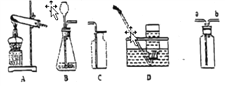
【题目】实验室制取气体时需要是一些装置如图所示,请回答下列问题:
(1)写出有序号的仪器名称:①_____,②_____.
(2)实验室制取氧气和二氧化碳均可选用的装置组合为__,选用相同发生装置的原因是:____.
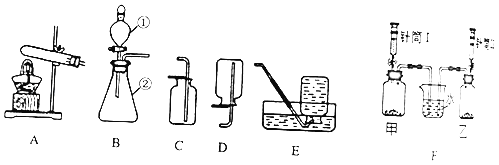
(3)某兴趣小组同学设计F装置,甲和乙中各盛有0.5g二氧化锰,同时将针筒Ⅰ中5mL5%的过氧化氢溶液和针筒Ⅱ中_____mL 15%的过氧化氢溶液注入甲和乙中,关闭弹簧夹,发现烧杯中右侧导管中产生气泡的速度比右侧快,说明化学反应速率与_____有关?该反应的化学方程式为:_____.
【答案】 分液漏斗 锥形瓶 BC 反应物均为固体和液体,反应都不需要加热 5 反应物浓度 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
【解析】(1)①是分液漏斗。②是锥形瓶。(2)实验室制取二氧化碳用固液常温型装置,收集二氧化碳只能用向上排空气法。实验室用过氧化氢溶液制取氧气,用固液常温型装置,氧气的密度比空气的密度大,可用向上排空气法,故选BC。(3)做对比实验,必须控制变量,两个实验中只有过氧化氢溶液的浓度不相同,才能探究出反应物的浓度对反应速率有无影响,故填5ml。该实验说明化学反应速率与反应物的浓度有关。反应的化学方程式为:2H2O2![]() 2H2O + O2↑ 。
2H2O + O2↑ 。

 53天天练系列答案
53天天练系列答案【题目】空气中氧气含量测定的再认识。
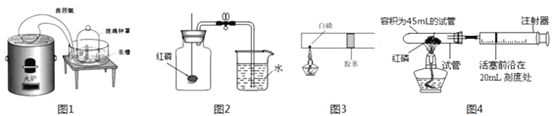
【经典赏析】教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1),通过该实验能比较准确的测定出氧气体积分数,原因是_________________(填序号,可多选)。
A.在汞槽中起到了液封的作用,保证了实验在密闭环境下完成
B.该反应的生成物加热分解又能得到汞和氧气
C.汞在空气中反应剧烈,实验在很短的时间内就能完成
D.能将密闭装置内空气中的氧气几乎耗尽
【实验回顾】目前,实验室常用红磷燃烧的方法测定空气中氧气的含量(实验装置如图2),写出红磷燃烧的符号表达式:_____________。
兴趣小组用该方法测出的数据如下表所示:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 |
120mL | 100mL | 85mL |
请计算出空气中氧气含量___________(计算结果保留一位小数)
【提出问题】用该方法测出的氧气含量为什么会偏小?
【进行猜想】(1)红磷的量不足;(2)___________(任写一条)
【实验改进1】该实验仍有可改进之处,小明在老师的帮助下设计了新的实验,用白磷代替红磷进行实验(实验装置如图3),改进后的优点有__________(填序号,可多选)。
(提示:白磷在40℃就能燃烧,燃烧产物与红磷的燃烧产物相同)
A.反应容器体积小,药品消耗少
B.装置简洁,减少了甲图装置中导管引起的误差
C.白磷比红磷着火点高,使用更安全
D.容器内径相等,易准确推算出空气中氧气的含量
【实验改进2】小红提出如使用注射器可以更准确的测定氧气体积(实验装置如图4),则在整个实验过程中,注射器活塞的变化是_____,最终注射器活塞的前沿停在___mL处。