题目内容
【题目】(6分) 水和溶液在生命活动和生产、生活中起着十分重要的作用。
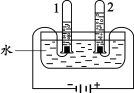
(1)下图实验中,当试管1中气体的体积为6mL时,试管2中气体体积约为 mL,发生反应的化学方程式为________。
(2)水常用来配制各种溶液,硝酸钾溶液中的溶质为________。
(3)农业生产常用溶质的质量分数为10% ~ 20%的NaCl溶液来选种。现将300 g 25%的NaCl溶液稀释为15%的NaCl溶液,需要加水的质量为________g。
(4)根据下表回答问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度 /g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |
① 60 ℃时,向两个分别盛有50 g NaCl和NH4Cl的烧杯中,各加入100 g的水,充分溶解后,为饱和溶液的是________溶液。
② 将上述实验后的两个烧杯均降温至40℃。下列说法中,正确的是________(填字母序号)。
A.两个烧杯中的溶液均为饱和溶液
B.两个烧杯中溶液的质量都可能不变
C.两个烧杯中溶液的质量减小的一样多
D.两个烧杯中溶质的质量分数都一定减小
【答案】(1)3 2H2O通电2H2↑+ O2↑ (2)KNO3
(3)200 (4)① NaCl ② AD
【解析】
试题分析:(1)电解水的实验中,口诀:正氧负氢,氢二氧一,即与电源正极相连产生的是氧气,与电源负极相连产生的是氢气,且氢气体积是氧气体积的2倍,所以当试管1中气体的体积为6mL时,试管2中气体体积约为3mL,发生反应的化学方程式为:2H2O通电2H2↑+ O2↑
(2)溶液的名称:溶质的溶剂溶液,当溶剂为水时,都省略不说,硝酸钾溶液中的溶质为KNO3
(3)现将300 g 25%的NaCl溶液稀释为15%的NaCl溶液,稀释过程中溶质的质量不变,所以可设需水的质量为x,可列式:300g×25%=(300g+x)×15%,x=200g
(4)①根据表中的溶解度数值,60 ℃时,NaCl的溶解度为37.3g,NH4Cl的溶解度为55.2g,故向两个分别盛有50 g NaCl和NH4Cl的烧杯中,各加入100 g的水,充分溶解后,为饱和溶液的是NaCl溶液,②当降温到40℃,此时NaCl的溶解度为36.6g,NH4Cl的溶解度为45.8g,所以都成为饱和溶液,A、两个烧杯中的溶液均为饱和溶液,正确,B、NaCl和NH4Cl都有晶体析出,两个烧杯中溶液的质量都发生了变化,错误,C、NaCl和NH4Cl的溶解度随温度的变化趋势不同,两个烧杯中溶液的质量减小的不一样,错误,D,因为降温后,NaCl和NH4Cl都有晶体析出,而溶剂不变,所以两个烧杯中溶质的质量分数都一定减小,正确,选AD