题目内容
【题目】(7分)为综合利用生产过程中的副产品CaSO4,某化工厂设计了以下制备(NH4)2SO4的工艺流程:
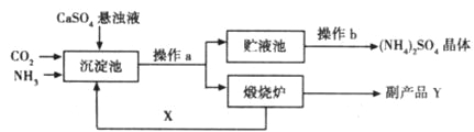
(1)此流程中,在沉淀池发生的化学反应为CO2+2NH3+CaSO4+H2O==CaCO3↓+ (NH4)2SO4
在煅烧炉中发生的化学反应方程式为 ;该工艺中可循环使用的X为 (填化学式);副产品Y有何用途 (填一种即可)。
(2)从贮液池中获得(NH4)2SO4晶体要进行操作b,操作b是。若经过一定处理后的贮液池中,形成30℃时(NH4)2SO4的饱和溶液,则此时溶质质量分数为 (已知30℃时硫酸铵的溶解度为78g)。
(3)欲制备6.6t (NH4)2SO4晶体,理论上需要CaSO4多少吨?
【答案】(1)CaCO3![]() CaO+CO2↑ CO2 食品干燥剂等
CaO+CO2↑ CO2 食品干燥剂等
(2)蒸发 43.8%
(3)6.8吨
【解析】
试题分析:(1)煅烧炉中的物质是碳酸钙,化学反应方程式为:CaCO3![]() CaO+CO2↑;该工艺中可循环使用的X为CO2;其中副产品Y是氧化钙,用途是:食品干燥剂等
CaO+CO2↑;该工艺中可循环使用的X为CO2;其中副产品Y是氧化钙,用途是:食品干燥剂等
(2)从贮液池中获得(NH4)2SO4晶体要进行操作b,操作b是:蒸发,若经过一定处理后的贮液池中,形成30℃时(NH4)2SO4的饱和溶液,已知30℃时硫酸铵的溶解度为78g,所以此时溶质质量分数为=78g/178g×100%=43.8%
(3)根据化学方程式:CO2+2NH3+CaSO4+H2O==CaCO3↓+ (NH4)2SO4中(NH4)2SO4与CaSO4的质量关系,即可算出CaSO4的质量
解:设CaSO4的质量为x
CO2+2NH3+CaSO4+H2O==CaCO3↓+ (NH4)2SO4
136 132
x 6.6t
136:132=x:6.6t
x=6.8t

 走进文言文系列答案
走进文言文系列答案【题目】(6分) 水和溶液在生命活动和生产、生活中起着十分重要的作用。
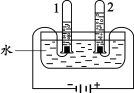
(1)下图实验中,当试管1中气体的体积为6mL时,试管2中气体体积约为 mL,发生反应的化学方程式为________。
(2)水常用来配制各种溶液,硝酸钾溶液中的溶质为________。
(3)农业生产常用溶质的质量分数为10% ~ 20%的NaCl溶液来选种。现将300 g 25%的NaCl溶液稀释为15%的NaCl溶液,需要加水的质量为________g。
(4)根据下表回答问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度 /g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |
① 60 ℃时,向两个分别盛有50 g NaCl和NH4Cl的烧杯中,各加入100 g的水,充分溶解后,为饱和溶液的是________溶液。
② 将上述实验后的两个烧杯均降温至40℃。下列说法中,正确的是________(填字母序号)。
A.两个烧杯中的溶液均为饱和溶液
B.两个烧杯中溶液的质量都可能不变
C.两个烧杯中溶液的质量减小的一样多
D.两个烧杯中溶质的质量分数都一定减小