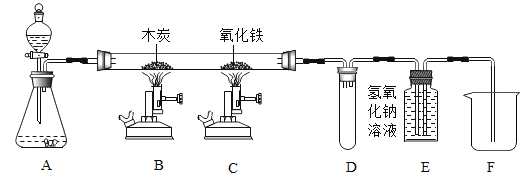
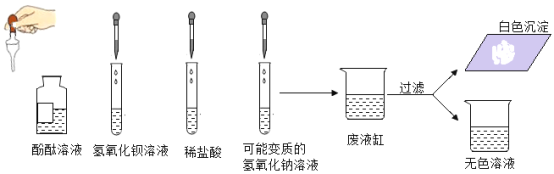
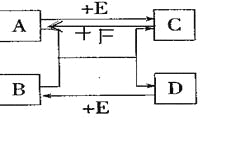
题目内容
【题目】用元素符号或化学式表示:
(1)2个铁原子_____
(2)4个氢分子_____
(3)5个碳酸根离子_____
(4)已知浓硝酸是一种易挥发的强酸,见光易分解,其分解的反应方程式为:4HNO3=2H2O+4NO2↑+X↑。根据上述信息,回答下列问题:
①浓硝酸的化学性质_____(写出一种即可);
②二氧化氮中氮、氧元素的质量比_____(最简比);
③判断X的化学式_____。
【答案】2Fe 4H2 ![]() 见光易分解 7:16 O2
见光易分解 7:16 O2
【解析】
分清化学用语所表达的对象是分子、原子、离子,根据物质化学式的书写规则并在其适当的位置加上计量数;根据化学性质是在化学变化中表现出来的性质结合题干对硝酸的介绍,来推断硝酸的化学性质;根据二氧化氮的化学式,计算出二氧化氮中氮、氧元素的质量比;利用反应的化学方程式,根据反应前后原子种类、个数不变,推断生成物X的化学式;
(1)元素符号前面加数字表示原子个数,所以2个铁原子符号为:2Fe,故填:2Fe。
(2)化学式前面加数字表示分子个数,所以4个氢分子符号为:4H2,故填:4H2。
(3)离子符号前面加数字表示离子的个数,所以5个碳酸根离子符号为![]() ,故填:
,故填:![]() 。
。
(4)①根据题给信息可以知道,硝酸见光分解,表明硝酸化学性质不稳定,见光易分解;故填:见光易分解。
②NO2中氮、氧元素的质量比=14:(16×2)=7:16;故填:7:16。
③反应前4HNO3中含H、N、O原子个数分别为4、4、12,而反应后2H2O、4NO2中共含有H、N、O原子个数分别为4、4、10,结合质量守恒定律的实质:反应前后原子种类、个数不变,可判断X分子由2个O原子构成,则物质X的化学式为O2;故填:O2。

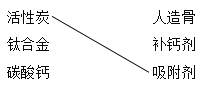
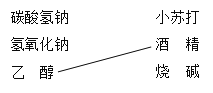
【题目】(1)补齐连线。________
A组 物质——用途 | B组 物质——俗称 |
|
|
(2)金属在人类的生活、生产中被广泛应用。
①《国家宝藏》节目介绍了云南省博物馆馆藏青铜文物——四牛金骑士铜贮贝器。青铜是重要的铜合金,其硬度_______(填“大于”或“小于”)纯铜。铜常用作导线,利用了铜的_______和延展性。
②地球上的金属资源广泛地存在于地壳和海洋中,地壳中含量最多的金属元素是_______。人类每年要从矿石中提取大量的金属,提取量最大的是铁,磁铁矿的主要成分是_______。