题目内容
【题目】47中化学实验小组的同学们为了探究溶液中离子的成分进行了如下实验,如图所示。
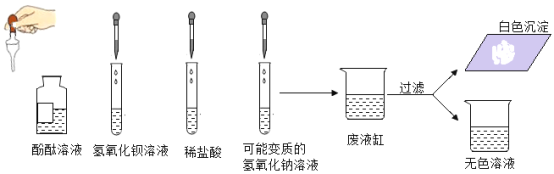
帝屹同学分别向装有少量氢氧化钡溶液、稀盐酸和可能变质的氢氧化钠溶液中滴加几滴酚酞溶液,帝屹同学发现在向氢氧化钠溶液中滴加酚酞溶液后出现红色,她认为氢氧化钠溶液没有变质,请你对她的结论进行评价_____。同学们认真观察实验后,将三支试管都倒入同一个废液缸中,观察到溶液中有气泡出现,最终得到白色沉淀后过滤,同学们对所得的无色溶液中含有的离子的成分进行了如下探究。
[实验与讨论]:同学们根据物质间的反应原理推出一定存在的离子是:_____。
[提出问题]:无色溶液中含有哪些离子? (不考虑酚酞)
[猜想与假设]:甲同学猜想:只含有Na+、Cl-
乙同学猜想: Na+、 Cl-、OH-、 CO32-
丙同学猜想: Na+、Cl-、Ba2+、 H+
丁同学猜想: Na+、 Cl-、Ba2+
[实验与讨论]:同学们根据溶液的颜色,可得出_____同学的猜想是错误的;
又根据其他实验现象推出_____同学的猜想是错误的,原因是_____。丁同学是分析溶液中氯化钠是溶于水的生成物一定存在,而混合后生成的氯化钡经反应后可能有剩余于是得出自己的猜想,丁同学为了验证自己的猜想,取少量无色溶液于试管中,加入少量的硝酸银溶液,观察到溶液中产生白色沉淀,于是得出自己的猜想正确,请你对丁同学的结论进行评价_____。经过同学们的共同能力,经过合理的实验得出了溶液中的离子成分。
[反思与评价]:通过上述探究活动,当根据溶质种类确定溶液中离子成分时,可以先确定一定存在的溶质从而确定一定存在的离子,再加入合理的试剂验证可能存在的溶质与一定存在的溶质中_____的离子是否存在,就可以确定溶液中离子的成分。
【答案】她的结论不正确,氢氧化钠和变质后生成的碳酸钠溶液均显碱性,都能使酚酞溶液变红,所以不能确定氢氧化钠未变质(或若氢氧化钠部分变质或完全变质后溶液都显碱性,都能使酚酞溶液变红,不能确定未变质) Na+、Cl- 乙 丙 混合后产生白色沉淀为碳酸钡,碳酸钡与盐酸(与氢离子)反应不共存,所以溶液中一定不含有氢离子,丙同学错误 不正确,硝酸银溶液与氯化钠和氯化钡溶液均发生反应产生白色沉淀,而氯化钠是溶于水的生成物一定存在,加入硝酸银溶液一定产生白色沉淀,不能确定氯化钡,所以不能证明钡离子是否存在(或氯化钠是溶于水的生成物一定存在,溶液中一定含有氯离子,加入硝酸银一定产生白色沉淀,不能确定钡离子是否存在) 不相同(或不一样)
【解析】
氢氧化钠和二氧化碳反应生成碳酸钠和水;盐酸和氢氧化钡反应生成氯化钡和水,和氢氧化钠反应生成氯化钠和水,和碳酸钠反应生成氯化钠、水和二氧化碳;碳酸钠和氯化钡反应生成白色沉淀碳酸钡和氯化钠。
她的结论不正确,这是因为氢氧化钠和变质后生成的碳酸钠溶液均显碱性,都能使酚酞溶液变红,所以不能确定氢氧化钠未变质(或若氢氧化钠部分变质或完全变质后溶液都显碱性,都能使酚酞溶液变红,不能确定未变质);
实验与讨论;
同学们根据物质间的反应原理推出一定存在的离子是氯离子、钠离子(Na+、Cl-),这是因为生成物中一定含有易溶于水的氯化钠;
实验与讨论:
同学们根据溶液的颜色,可得出乙同学的猜想是错误的,这是因为溶液是无色的,说明溶液显中性或显酸性,而含有氢氧根离子、碳酸根离子的溶液显碱性;
又根据其他实验现象推出丙同学的猜想是错误的;原因是混合后产生白色沉淀为碳酸钡,碳酸钡与盐酸(与氢离子)反应不能共存,所以溶液中一定不可能含有氢离子,丙同学错误;
丁同学的结论不正确,这是因为硝酸银溶液与氯化钠和氯化钡溶液均发生反应产生白色沉淀,而氯化钠是溶于水的生成物一定存在,加入硝酸银溶液一定产生白色沉淀,不能确定氯化钡,所以不能证明钡离子是否存在(或氯化钠是溶于水的生成物一定存在,溶液中一定含有氯离子,加入硝酸银一定产生白色沉淀,不能确定钡离子是否存在);
反思与评价:
通过上述探究活动,当根据溶质种类确定溶液中离子成分时,可以先确定一定存在的溶质从而确定一定存在的离子,再加入合理的试剂验证可能存在的溶质与一定存在的溶质中不相同(或不一样)的离子是否存在,就可以确定溶液中离子的成分。

【题目】下列四个图象中,能正确表示对应变化关系的是( )
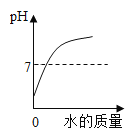
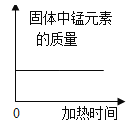
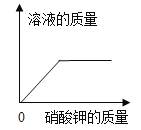
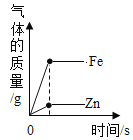
A向一定量稀盐酸中加水稀释 | B加热一定量的高锰酸钾固体 | C一定温度下,向不饱和硝酸钾溶液中加入硝酸钾 | D向等质量铁、锌分别加入足量稀盐酸 |
|
|
|
|
A.AB.BC.CD.D
【题目】下图是某实验小组对氢氧化钠部分性质的探究过程:

小红用手触摸烧杯②的外壁,感觉发烫,这是由于氢氧化钠固体溶于水时会_______(填“吸热"或“放热”),烧杯③的溶液呈_________色。
小红取烧杯③中的适量溶液于试管中,滴加稀盐酸后振荡,溶液呈无色,于是她认为氢氧化钠与稀盐酸恰好完全反应。该反应的化学方程式为________。
小明不同意她的观点,理由是如果稀盐酸过量,溶液也呈无色。
[提出问题]氢氧化钠与稀盐酸是否恰好完全反应呢?
[实验探究]
方案 | 方案一 | 方案二 | 方案三 |
实验操作 | 用洁净的玻璃棒蘸取反应后溶液,滴到pH试纸上,将试纸显示的颜色与标准比色卡比较 | 取适量反应后溶液于试管中,滴加AgNO3溶液 | 取适量反 应后溶液于试管中,滴加Na2CO3溶液 |
实验现象 | 试纸变为红色,pH______7 | 有_______生成 | 有气泡冒出 |
实验结论 | 稀盐酸过量 | 稀盐酸过量 | 稀盐酸过量 |
[得出结论]氢氧化钠与稀盐酸没有恰好完全反应。
[交流讨论]同学们经讨论,发现上述三个方案中有一个不能达到探究目的,它是方案_______,理由是________。