题目内容
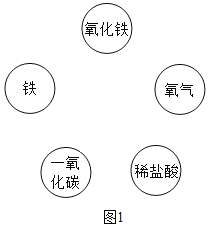
【题目】碳及碳的化合物在人类生产生活中应用广泛。
(1)金刚石和石墨物理性质相差很大,原因是碳原子的________不同。
(2)家用燃料含有碳元素,燃烧不充分会产生_______气体,与血液中的血红蛋白结合,使人体中毒。
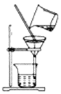
(3)打开一瓶碳酸饮料的瓶盖,塞上带导管的橡皮塞(如图所示):
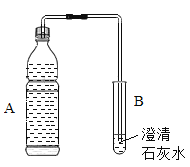
① A中的现象是______,B中的现象是______。
② A中现象说明气体的溶解度随压强的减小而______。
(4)利用太阳能可将CO2和水转化成合成气(CO和H2),再将CO和H2合成甲醇(CH3OH)。在合成甲醇的反应中,CO和H2的分子数之比是______。
【答案】排列方式 CO 出现大量气泡 澄清石灰水变浑浊 减小 1:2
【解析】
(1)金刚石和石墨都是由碳元素组成,但是碳原子的排列方式不同,故物理性质差异很大,故填:排列方式;
(2)碳不完全燃烧会生成一氧化碳,一氧化碳有毒,极易与血液中的血红蛋白结合,从而使血红蛋白不能再与氧气结合,造成生物体缺氧。故填:CO;
(3)①打开一瓶碳酸饮料的瓶盖,压强减小,二氧化碳的溶解度降低,二氧化碳散逸出来,故A中出现大量气泡;二氧化碳能使澄清石灰水变浑浊,故B中的现象是:澄清石灰水变浑浊;
②A中出现大量气泡,说明二氧化碳跑了出来,说明气体的溶解度随压强的减小而减小;
(4)一氧化碳与氢气合成甲醇的化学方程式为: ,故在合成甲醇的反应中,CO和H2的分子数之比是:1:2。
,故在合成甲醇的反应中,CO和H2的分子数之比是:1:2。

 名校课堂系列答案
名校课堂系列答案【题目】小李和小王同学对化学计算很有心得,以下是他们解答一道计算题的实录。请你一起参与研究并完成相关问题。( 计算结果精确到0.01g)
题目已知: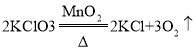 ,两位同学为了测定实验室中氯酸钾药品是否纯净,取2. 5g该药品与0. 5g二氧化锰混合。加热该混合物t3时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加t2 、t3、t4时间后剩余固体的质量,记录数据如下表:
,两位同学为了测定实验室中氯酸钾药品是否纯净,取2. 5g该药品与0. 5g二氧化锰混合。加热该混合物t3时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加t2 、t3、t4时间后剩余固体的质量,记录数据如下表:
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量/g | 2.12 | 2.08 | 2.04 | 2.04 |
(1)两同学一致认为氯酸钾已经完全反应的时间为_____(选填“t1”、 “t2”、“t3”、“t4”) 。
(2)小李根据质量守恒定律很快得到(2.5g+0.5g-2.04g)是_____(填化学式)的质量。
(3)请你计算:该药品中氯酸钾的质量,并判断该药品是否纯净?_____
【题目】同学们用“硝酸钡、氢氧化钡、碳酸钾”三种物质的溶液进行实验。
(1)甲组同学用______测得碳酸钾溶液的pH大于7,同学们因此推理得知:呈碱性的溶液不一定是碱的溶液。
(2)乙组同学按如图所示进行实验,此时观察到的实验现象是______,请写出其中一个反应的化学方程式________。实验完毕,充分振荡U形玻璃管,将管内的物质过滤。同学们对滤液成分进行了进一步的探究。
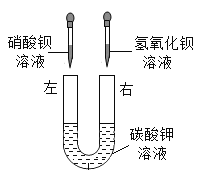
(提出问题)滤液中除K+,还含有什么离子?
(作出猜想)猜想一:含有OH-、NO3-、CO32-
猜想二:含有Ba2+、______(填离子符号)
猜想三:含有OH-、NO3-
(实验探究)
实验操作 | 实验现象 | 结论 |
取滤液于试管中,向其中滴加少量的硫酸钠溶液 | 无明显现象 | 猜想一正确 |
(评价与交流)
(1)你认为乙组同学们的结论________(填“正确”或“不正确”),理由是________。
(2)同学们经过讨论后一致认为:若将硫酸钠溶液换成足量的________,就能确定滤液中的离子成分。