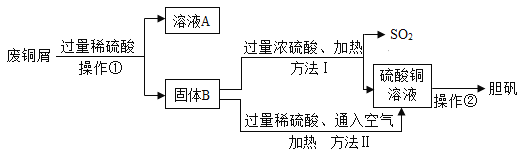
题目内容
【题目】工业上用粗盐为原料制取氢氧化钠的流程如下:
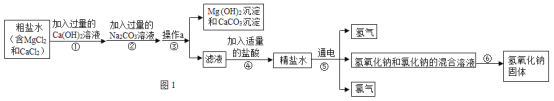

(1)步骤①的目的是除去粗盐水中的氯化镁,写出步骤②中一个反应的化学方程式______。
(2)步骤③所得滤液中含有的离子有____________。
(3)请将步骤⑤的化学方程式补充完整: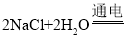 ______,反应后氯元素的化合价_______。(填“升高”或“降低”)
______,反应后氯元素的化合价_______。(填“升高”或“降低”)
(4)结合图2分析,步骤⑥中得到氢氧化钠固体的方法是_________。
【答案】![]() 或
或![]() Na+ 、Cl- 、CO32-、OH-
Na+ 、Cl- 、CO32-、OH- ![]() 升高 降温结晶
升高 降温结晶
【解析】
(1)步骤②中碳酸钠与氯化钙反应生成碳酸钙和氯化钠,该反应的化学方程式为:![]() ;或者碳酸钠与过量的氢氧化钙反应生成碳酸钙和氢氧化钠,该反应的化学方程式为:
;或者碳酸钠与过量的氢氧化钙反应生成碳酸钙和氢氧化钠,该反应的化学方程式为:![]() ;
;
(2)步骤①为氢氧化钙与氯化镁反应生成氢氧化镁沉淀和氯化钙,步骤②为碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠与过量的氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,碳酸钠过量,故步骤③所得滤液中含有的离子有:Na+ 、Cl- 、CO32-、OH-;
(3)由图可知,步骤⑤的化学方程式为: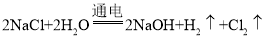 ;
;
反应前氯元素的化合价为:-1价,反应后,氯元素的化合价为0,故反应后,氯元素的化合价升高;
(4)由图2可知,氢氧化钠的溶解度受温度的影响较大,氯化钠的溶解度受温度的影响较小,故步骤⑥中得到氢氧化钠固体的方法是:降温结晶。

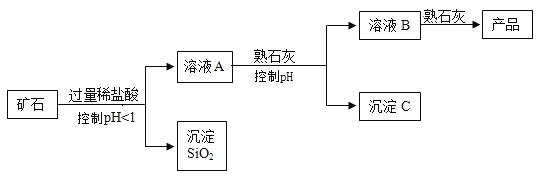
【题目】氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、 CuO和SiO2组成。用它制备氢氧化镁的流程示意图如下:
部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀 | 1.9 | 4.2 | 9.1 |
完全沉淀 | 3.2 | 6.7 | 11.1 |
(1)溶液A中的阳离子有________________种。溶液A与熟石灰反应控制PH范围为_______________。
(2)沉淀C的成分是________________。
(3)溶液B与熟石灰反应的化学方程式是______________。该反应类型为_______________反应。
(4)从理论上讲,矿石中镁元素质量与产品中镁元素质量是否相等? _______________(填“是”或“否”)。
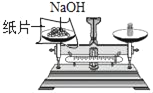
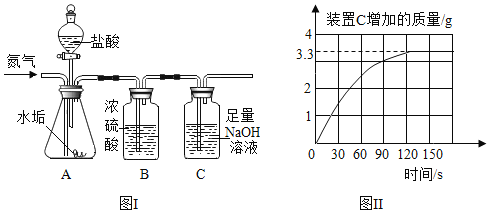
【题目】2018 年合肥市中考理科实验操作中,需要在 NaOH 溶液滴加酚酞溶液。分组操作练习时,天宇同学观察到了意想不到的现象:有的溶液变红后很快褪成无色;有的溶液中出现白色浑浊物。
(提出问题)分组实验中,出现意想不到的现象的原因是什么呢?
(查阅资料)酚酞溶液由酚酞固体溶于酒精配制而成。
(猜想与假设)Ⅰ.红色褪去,可能是酚酞与 O2 发生了反应有关。
Ⅱ.红色褪去,可能与 NaOH 溶液和空气中的 CO2 反应有关。
(进行实验)
实验 | 实验操作 | 实验现象 | |
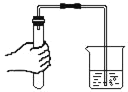
1 | 将 NaOH 溶液加热煮沸, 向冷却后的溶液中 滴入酚酞,并在其上方覆盖一层植物油 | 溶液变红,过一会儿红色消失 | |
2 | 向盛有 2 mL 氢氧化钠溶液的试管中通入足量二氧化碳,再滴入酚酞溶液 | 溶液变红,一段时间红色不褪去 | |
3 |
| 1号试管 0.1min 红色褪去 2号试管 5min 红色褪去 3号试管 30min 红色明显变浅 4号试管 120min 红色无明显变化 (注:min 表示分钟) | |
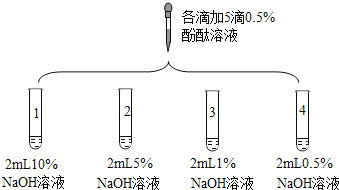
4 | 取 3 支试管,分别加入 2 mL 水,再分别滴入 5 滴不同浓度的酚酞溶液。 | 酚酞溶液浓度/% | 浑浊程度 |
5 | 大量浑浊物 | ||
2 | 少量浑浊物 | ||
0.5 | 无浑浊物 | ||
(解释与结论)
(1)实验 1 中,将 NaOH 溶液煮沸并滴加植物油的作用是_____。
(2)假设Ⅱ不成立的理由是_____(用化学方程式表示)。
(3)由实验 3 出现的现象得出的两个结论是_____、_____。
(4)由实验 4 的现象可推知相同温度、压强相同时,酚酞在水中的溶解度_____酚酞在酒精中的溶解度(填“大于”、“小于”或“等于”)。