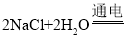题目内容
【题目】现有工厂丢弃的废铜屑(铜屑表面呈绿色,其中混有少量生锈铁屑)。某兴趣活动小组同学欲利用其制取胆矾(CuSO4·5H2O),他们设计了下面的两种制取流程。已知:Cu+Fe2(SO4)3=2FeSO4+CuSO4,请回答问题。
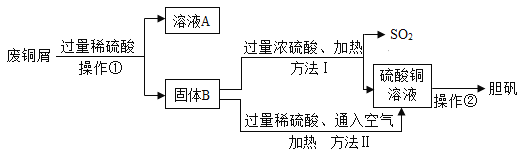
(1)铜屑表面呈绿色的物质化学式是Cu2(OH)2CO3,其中Cu 的化合价是_____。操作①所用到的玻璃仪器有:烧杯、玻璃棒和______。
(2)溶液A的溶质有_______(只写一种)。
(3)两种方法比较,符合绿色化学要求的是方法____。方法Ⅱ的化学反应方程式为2Cu + 2H2SO4 +___=2CuSO4+__;操作②的实验步骤为:蒸发浓缩、___。
【答案】+2 漏斗 FeSO4或CuSO4或H2SO4 Ⅱ O2 2H2O 降温结晶
【解析】
(1)Cu2(OH)2CO3中氢氧根显-1价,碳酸根显-2价,设铜的化合价为x,则2×x+(-1)×2+(-2)=0,解得x=+2;操作①是过滤,过滤中要用到的玻璃仪器:烧杯、漏斗和玻璃棒,故答案:+2;漏斗;
(2)铜绿和稀硫酸反应生成硫酸铜和水还有二氧化碳,氧化铁和稀硫酸反应生成硫酸铁和水而最终会有铜单质,根据信息提示“Cu+Fe2(SO4)3=2FeSO4+CuSO4”,硫酸铁会和铜反应生成硫酸亚铁,而铁屑也能和硫酸反应生成硫酸亚铁所以溶质有硫酸亚铁,由于硫酸过量,所以溶质也一定有硫酸.故答案:FeSO4或CuSO4或H2SO4;
(3)方法Ⅰ中产生二氧化硫,二氧化硫是有毒气体会污染空气,方法Ⅱ通入空气是铜、稀硫酸和氧气反应生成硫酸铜和水,方法Ⅱ环保,反应的方程式为:2Cu+2H2SO4+O2=2CuSO4+2H2O;硫酸铜溶液得到硫酸铜晶体先蒸发浓缩,再降温结晶即可;故答案:Ⅱ;O2;2H2O;降温结晶。

 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案【题目】如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中放入另一种物质,挤压胶头滴管加入液体,一段时间后甲装置中的气球明显胀大,乙装置中气球无变化(忽略液体体积对气球体积的影响)。则滴管和烧瓶中所用试剂可能是

甲 | 乙 | |
A | 稀硫酸和铜片 | 水和CO2 |
B | 双氧水和MnO2 | NaOH 溶液和CO2 |
C | 稀盐酸和Na2CO3 | 硫酸铜溶液和铁粉 |
D | 水和NH3 | 稀盐酸和锌粒 |
A.AB.BC.CD.D