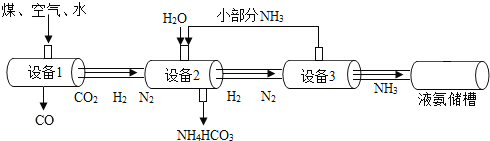
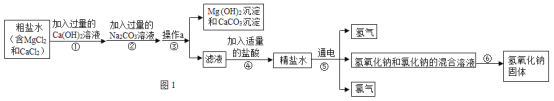
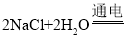题目内容
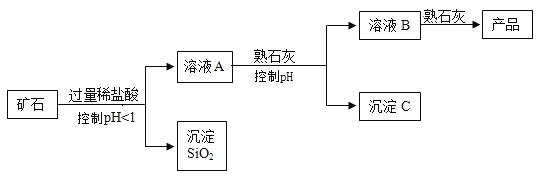
【题目】氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、 CuO和SiO2组成。用它制备氢氧化镁的流程示意图如下:
部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀 | 1.9 | 4.2 | 9.1 |
完全沉淀 | 3.2 | 6.7 | 11.1 |
(1)溶液A中的阳离子有________________种。溶液A与熟石灰反应控制PH范围为_______________。
(2)沉淀C的成分是________________。
(3)溶液B与熟石灰反应的化学方程式是______________。该反应类型为_______________反应。
(4)从理论上讲,矿石中镁元素质量与产品中镁元素质量是否相等? _______________(填“是”或“否”)。
【答案】四 6.7-9.1 (范围合理即可) Fe(OH)3、Cu(OH)2 ![]() 复分解 是
复分解 是
【解析】
(1)加入过量的稀盐酸,氧化镁与稀盐酸反应生成氯化镁和水,三氧化二铁和稀盐酸反应生成氯化铁和水,氧化铜和稀盐酸反应生成氯化铜和水,由于稀盐酸过量,故溶液A中的阳离子有:Cu2+、Fe3+、Mg2+、H+共四种离子;
溶液A与熟石灰反应控制pH范围为:6.7-9.1,使氢氧化镁不能形成沉淀,形成了氢氧化铁和氢氧化铜沉淀;
(2)氯化铁与氢氧化钙反应生成氢氧化铁沉淀和氯化钙,氯化铜和氢氧化钙反应生成氢氧化铜沉淀和氯化钙,由于未达到镁离子形成沉淀的pH值,未形成氢氧化镁沉淀,故沉淀C的成分是:Fe(OH)3、Cu(OH)2;
(3)溶液B与熟石灰反应,实际是氯化镁与熟石灰反应生成氢氧化镁和氯化钙,该反应的化学方程式为:![]() ,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应;
,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应;
(4)根据质量守恒定律,化学反应前后,元素的质量不变,故从理论上讲,矿石中镁元素质量与产品中镁元素质量相等。

 口算能手系列答案
口算能手系列答案