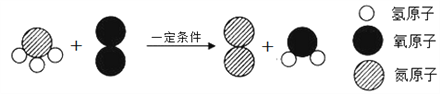
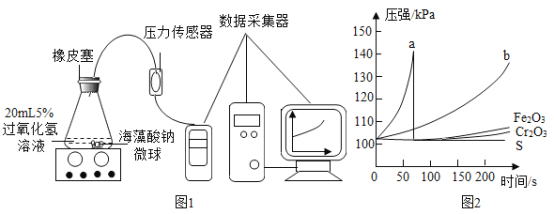
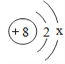��Ŀ����
����Ŀ����ѧʵ��С���ͬѧ����ѧϰ����Ļ�ѧ���ʺ���������ͼ��ʾʵ�飺
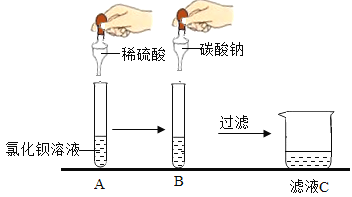
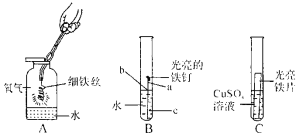
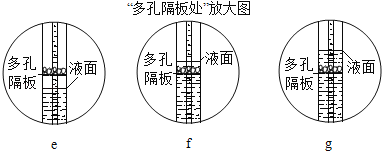
��ʵ���¼��A�����з�����Ӧ�Ļ�ѧ����ʽ_____����ͼ����ͬѧ���ڵμ�̼������Һ�Ĺ����У��ȹ۲쵽�����ݲ����������ֳ��ֳ���������ͬѧ�ǵó��Թ���������A����ʱ�ѱ��ľ�������Ϊ���ǵĽ���_____�����ǻ��ǣ���ȷ�ġ�������_____��
��̽�����Ϊ�˿�ѧ������Һ��ͬѧ���ֿ�ʼ̽����ҺC�ж������ļ������ӡ�
��������⣩��ҺC�����ļ������ӣ�
����������裩��ͬѧ���룺Na����Cl������ͬѧ���룺Na����Cl����Ba2+����IJ��룺_____�������ӷ��ţ���
������뽻����Ϊ��֤����������һ������������м�ͬѧ��Ϊ�����Էֱ�ȡ������ֻ�Թ��У�Ȼ��������һֻ�Թ��еμ�̼������Һ����������������һ֧�Թ��м����������ἴ�ɴﵽĿ�ģ���ͬѧ��Ϊֻ��һֻ�ྻ�Թܣ�ֻȡһ��C�з�Һ��ֻ��һ�������Լ����ɵó����ۣ�����Ϊ�����Լ���_____��������_____��
����˼���ܽᣩ����ͬѧ�����۷�����Ϊ���������������ͷ�ʽ�����кܶ��֣��ӻ�ѧʵ��ĽǶ�ʵ��Ҫ�����������ԡ�_____����Կ�ѧ�ͼ��ġ�
���𰸡�![]() �� �μ�̼������Һ�Ĺ������ܲ���������˵��A�������Ȼ�����ʣ�࣬�������ѱ��ľ�
�� �μ�̼������Һ�Ĺ������ܲ���������˵��A�������Ȼ�����ʣ�࣬�������ѱ��ľ� ![]() ϡ���� �����Ӻ�����������������ᱵ�����������Ӻ�̼����������ɶ�����̼��ð���� ʵ�鲽��
ϡ���� �����Ӻ�����������������ᱵ�����������Ӻ�̼����������ɶ�����̼��ð���� ʵ�鲽��
��������
ϡ������Ȼ����������ᱵ�����ᣬϡ�����̼���Ʒ�Ӧ���������ơ�ˮ�Ͷ�����̼�������̼���Ʒ�Ӧ�����Ȼ��ơ�ˮ�Ͷ�����̼��̼���ƺ��Ȼ�����Ӧ����̼�ᱵ���Ȼ��ơ�
[ʵ���¼]
A�����з�����Ӧ��ϡ������Ȼ����������ᱵ�����ᣬ��Ӧ�Ļ�ѧ����ʽΪ![]() ����ͬѧ���ڵμ�̼������Һ�Ĺ����У��ȹ۲쵽�����ݲ����������ֳ��ֳ��������ֳ�����̼���ƺ��Ȼ�����Ӧ����̼�ᱵ���Ȼ��ƣ�˵��A�������Ȼ�����ʣ�࣬��������A����ʱ�ѱ��ľ��Ľ�������ȷ�ġ������ǣ��μ�̼������Һ�Ĺ������ܲ���������˵��A�������Ȼ�����ʣ�࣬�������ѱ��ľ���
����ͬѧ���ڵμ�̼������Һ�Ĺ����У��ȹ۲쵽�����ݲ����������ֳ��ֳ��������ֳ�����̼���ƺ��Ȼ�����Ӧ����̼�ᱵ���Ȼ��ƣ�˵��A�������Ȼ�����ʣ�࣬��������A����ʱ�ѱ��ľ��Ľ�������ȷ�ġ������ǣ��μ�̼������Һ�Ĺ������ܲ���������˵��A�������Ȼ�����ʣ�࣬�������ѱ��ľ���
[���������]
���̼������Һ����������̼������ӣ��ʲ���Ϊ![]() ��
��
[����뽻��]
�����Ӻ�����������������ᱵ�����������Ӻ�̼�����������ˮ�Ͷ�����̼���������Լ���ϡ���ᣬ�����DZ����Ӻ�����������������ᱵ�����������Ӻ�̼����������ɶ�����̼��ð���ݡ�
[��˼���ܽ�]
����ͬѧ�����۷�����Ϊ���������������ͷ�ʽ�����кܶ��֣��ӻ�ѧʵ��ĽǶ�ʵ��Ҫ�����������ԡ�ʵ�鲽������Կ�ѧ�ͼ��ġ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�