题目内容
某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问
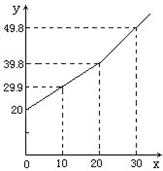
(1)铜锌合金与稀盐酸的质量比为 _________ 时,恰好完全反应;
(2)反应中共生成氢气 _________ g.
(3)合金中铜的质量分数是多少?(结果保留0.1%)
(2)反应中共生成氢气 _________ g.
(3)合金中铜的质量分数是多少?(结果保留0.1%)
(1)图中曲线明显变化时的折点表示物质恰好完全反应;折点对应的稀盐酸的质量为20g;合金的质量为20g.因此合金与稀盐酸的质量比为20g:20g=1:1.
(2)生成氢气的质量为20g+20g﹣38.8g=0.2g
(3)设合金中铜的质量分数为x.
Zn+2HCl=ZnCl2+H2↑
65 2
20g .(1﹣x) 0.2g
 =
= ,x=67.5%
,x=67.5%
答:(1)1:1.
(2)0.2g.
(3)合金中铜的质量分数67.5%.
(2)生成氢气的质量为20g+20g﹣38.8g=0.2g
(3)设合金中铜的质量分数为x.
Zn+2HCl=ZnCl2+H2↑
65 2
20g .(1﹣x) 0.2g
 =
= ,x=67.5%
,x=67.5%答:(1)1:1.
(2)0.2g.
(3)合金中铜的质量分数67.5%.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
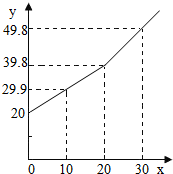 某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问:
某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问: 为了倡导环保理念,两会期间使用含有碳酸钙的“石头纸”.某研究小组为了测定其中碳酸钙0.88
为了倡导环保理念,两会期间使用含有碳酸钙的“石头纸”.某研究小组为了测定其中碳酸钙0.88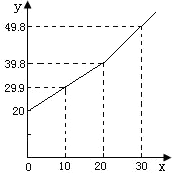 某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问:
某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问: 某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问:
某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问: