题目内容
【题目】我国研制的一种新型催化剂可将CO2和H2转化为甲醇(CH3OH)和X,该反应的微观示意图如图,下列说法错误的是
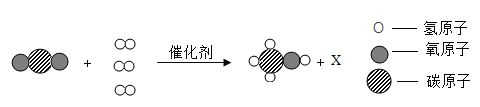
A.X的化学式为H2OB.反应前后原子的种类发生改变
C.化学变化的实质是原子的重新组合D.该反应遵循质量守恒定律
【答案】B
【解析】
根据微观示意图可知:CO2和H2在催化条件下转化为甲醇(CH3OH)和水,故其化学方程式为:CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
A、根据化学方程式为:CO2+3H2 CH3OH+H2O可知,X的化学式为H2O,故正确;
CH3OH+H2O可知,X的化学式为H2O,故正确;
B、根据质量守恒定律可知,应前后原子种类、数目都没有改变,故错误;
C、从该反应的反应过程可知化学变化的实质是分子分开成为原子,然后原子再重新组合成新分子的过程,故正确;
D、任何化学变化都遵循质量守恒定律,故正确。
故选B。

 阅读快车系列答案
阅读快车系列答案【题目】NaCl是重要的工业原料,工业上可用电解饱和食盐水的方法获取烧碱、氯气、氢气等物质。实验小组的同学现欲对一份久置的工业烧碱的成分进行探究。
(查阅资料)电解饱和食盐水的化学方程式为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
(提出问题)小组同学根据相关信息,对工业烧碱的成分作了如下猜想:
猜想一:NaOH、NaCl
猜想二:Na2CO3、NaCl
猜想三:_________________;
(实验探究)
为了验证猜想,小组同学进行了实验探究。首先取工业烧碱样品少许,配成溶液,待用。
(1)取样品溶液少许,滴加足量稀盐酸,有气泡产生,说明样品中含有________(填化学式),写出产生气泡的化学反应的方程式_________________;工业烧碱中含有该物质的原因是________(用化学方程式表示)。
(2)为了证明样品中含有NaCl,小组同学设计实验方案如下:先取样品溶液少量,向其中滴加足量的稀盐酸至不再产生气泡时,再向溶液中滴加AgNO3溶液,出现白色沉淀,加入稀硝酸后,沉淀不溶解,则样品中一定含有氯化钠。老师指出上述方案不合理,请说明理由_____;
(3)小组同学为进一步确认样品是否还含有氢氯化钠,设计了如下实验方案,请你将其补充完整。
实验操作步骤 | 实验现象 | 实验结论 |
①取样品溶液少许,加入足量氯化钙溶液,充分反应后静置 ②取反应后的溶液适量,滴加无色酚酞试液 | ①___________ ②____________ | 该样品中一定含有NaOH |
(反思与评价)
经过研究,小组同学认为,上述方案中,除了使用氯化钙以外,利用下列物质也可得到同样的效果,你认为下列哪些试剂是可行的_________(填序号)。
A Ca(OH)2 B Ca(NO3)2 C Ba(NO3)2 D Ba(OH)2
(数据处理)
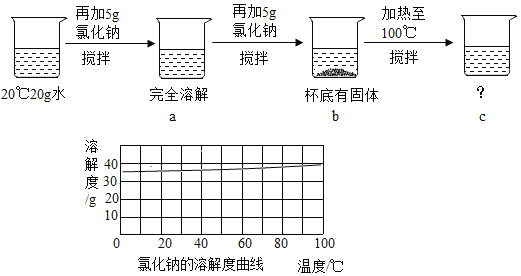
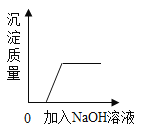
最终实验证实,该久置工业烧碱样品中含有氢氧化钠、氯化钠和碳酸钠。为了进一步确定该混合物中Na2CO3的质量分数,实验小组的同学取了10克该工业烧碱样品,加入足量的溶质质量分数为7.3%稀盐酸,实验测得生成CO2气体的质量与所加盐酸质量关系如图所示,请据图计算:
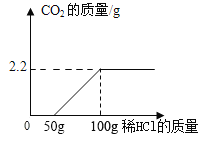
(1)该样品与稀盐酸完全反应时产生CO2的质量是____g。
(2)该样品中Na2CO3的质量分数____。
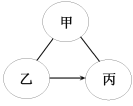
【题目】化学兴趣小组同学发现实验台上按如下顺序摆放着7瓶不同的无色溶液(如图所示),其中4、5号试剂瓶标签破损.
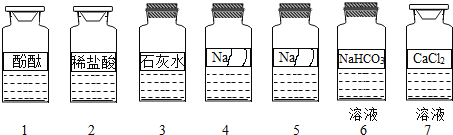
(提出问题)这两瓶试剂的成分分别是什么?
(查阅资料)①碱性的亚硫酸钠(Na2SO3)溶液、Na2CO3溶液与中性的CaCl2溶液均可发生复分解反应,产生白色沉淀.
②Na2SO3+2HCl=2NaCl+SO2↑+H2O.
③CO2与SO2均可以使澄清石灰水变浑浊.
(作出猜想)根据受损标签的信息,推测4、5号溶液可能分别是NaOH溶液、Na2CO3溶液、Na2SO3溶液或NaCl溶液中的一种.
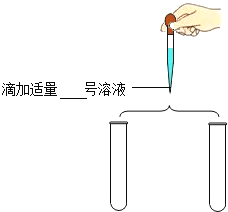
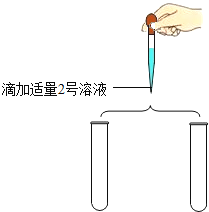
(实施方案)各取少量4、5号溶液于试管中,分别进行下列两组实验.
实验操作 | 实验现象 | 实验结论 |
实验1
| 溶液均由无色变成红色 | 4、5号溶液均不可能是上述猜想中的__溶液. |
实验2
| 均产生白色沉淀 | 4、5号溶液可能分别是Na2SO3溶液和Na2CO3溶液中的一种.写出其中一个反应的化学方程式 __. |
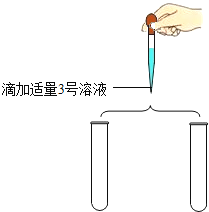
(继续实验)为了进一步确定4、5号溶液的成分,同学们分别取少量4、5号溶液于试管中继续实验.
实验操作 | 实验现象 | 实验结论 |
| __ | 4号溶液是Na2CO3溶液 5号溶液是Na2SO3溶液. |
(实验反思)同学们经过分析认为4号溶液还可能是变质的NaOH溶液.于是设计了以下实验方案进行验证.请完成下列实验报告.
实验操作 | 实验现象 | 实验结论 |
__ | __ | 4号溶液是部分变质的NaOH溶液. |