题目内容
对蜡烛(主要成分是石蜡)及其燃烧的探究
⑴取一支蜡烛,用小刀切下一小块,把它放入水中,蜡烛_______________,结论:石蜡的密度比水的密度_________;
⑵火柴火焰靠近蜡烛(不点燃)和蜡烛点燃后分别发生的现象是________________,___________________;根据此实验说明物理变化和化学变化的关系_________________。
⑶点燃蜡烛,观察到蜡烛火焰分为外焰.内焰.焰心三层。把一根火柴梗放在蜡烛的火焰中约1s后取出,可以看到火柴梗处在________的最先碳化。结论: ____________;
⑷熄灭燃烧的蜡烛,观察刚熄灭的蜡烛会产生一缕白烟,若用火柴火焰接触白烟,可以看到___________________,原因是______________________________________;
⑸放在同一平面上的两支蜡烛,一高一低,点燃以后,用一大烧杯罩在蜡烛上,一段时间后,发现____________________,原因是_______________________________________;
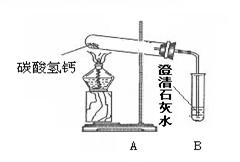
⑹再将一只干燥的烧杯罩在火焰上方,烧杯内壁出现水雾。片刻后取下烧杯,迅速向烧杯内倒入少量澄清的石灰水,振荡,澄清石灰水变浑浊,结论:石蜡中一定含有____元素。
⑺燃烧3.5g石蜡生成8.8g二氧化碳和5.4g水,由此可推断石蜡中还含有___元素。
⑴取一支蜡烛,用小刀切下一小块,把它放入水中,蜡烛_______________,结论:石蜡的密度比水的密度_________;
⑵火柴火焰靠近蜡烛(不点燃)和蜡烛点燃后分别发生的现象是________________,___________________;根据此实验说明物理变化和化学变化的关系_________________。
⑶点燃蜡烛,观察到蜡烛火焰分为外焰.内焰.焰心三层。把一根火柴梗放在蜡烛的火焰中约1s后取出,可以看到火柴梗处在________的最先碳化。结论: ____________;
⑷熄灭燃烧的蜡烛,观察刚熄灭的蜡烛会产生一缕白烟,若用火柴火焰接触白烟,可以看到___________________,原因是______________________________________;
⑸放在同一平面上的两支蜡烛,一高一低,点燃以后,用一大烧杯罩在蜡烛上,一段时间后,发现____________________,原因是_______________________________________;
⑹再将一只干燥的烧杯罩在火焰上方,烧杯内壁出现水雾。片刻后取下烧杯,迅速向烧杯内倒入少量澄清的石灰水,振荡,澄清石灰水变浑浊,结论:石蜡中一定含有____元素。
⑺燃烧3.5g石蜡生成8.8g二氧化碳和5.4g水,由此可推断石蜡中还含有___元素。
(1)浮在水面;小
(2)蜡烛熔化,蜡烛先熔化后燃烧;化学变化中常常伴随着物理变化,物理变化中不包含化学变化。
(3)外焰层,外焰的温度最高
(4)白烟能燃烧,蜡烛复燃;白烟是固态石蜡小颗粒
(5)低处的蜡烛先熄灭,高处的蜡烛后熄灭;二氧化碳不能燃烧不能支持燃烧,密度比空气大。
(6)C、H
(7)O
(2)蜡烛熔化,蜡烛先熔化后燃烧;化学变化中常常伴随着物理变化,物理变化中不包含化学变化。
(3)外焰层,外焰的温度最高
(4)白烟能燃烧,蜡烛复燃;白烟是固态石蜡小颗粒
(5)低处的蜡烛先熄灭,高处的蜡烛后熄灭;二氧化碳不能燃烧不能支持燃烧,密度比空气大。
(6)C、H
(7)O
(1)石蜡的密度比水的密度小,把它放入水中,蜡烛会浮在水面上;
(2)火柴火焰靠近蜡烛会看到蜡烛熔化,蜡烛点燃后会看到蜡烛先熔化后燃烧;根据此实验说明物理变化和化学变化的关系是化学变化中常常伴随着物理变化,物理变化中不包含化学变化.
(3)点燃蜡烛,观察到蜡烛火焰分为外焰.内焰.焰心三层,其中外焰燃烧最充分,温度最高,把一根火柴梗放在蜡烛的火焰中约1s后取出,可以看到火柴梗处在外焰层的最先碳化;
(4)熄灭燃烧的蜡烛,观察刚熄灭的蜡烛会产生一缕白烟,若用火柴火焰接触白烟,可以看到白烟能燃烧,蜡烛复燃;,原因是白烟是固态石蜡小颗粒;
(5)蜡烛燃烧生成二氧化碳,二氧化碳不能燃烧不能支持燃烧,密度比空气大,故会看到低处的蜡烛先熄灭,高处的蜡烛后熄灭;
(6)将一只干燥的烧杯罩在火焰上方,烧杯内壁出现水雾.片刻后取下烧杯,迅速向烧杯内倒入少量澄清的石灰水,振荡,澄清石灰水变浑浊,说明蜡烛燃烧生成水和二氧化碳,因为各元素在反应前后不变,水和二氧化碳中都含有碳、氢元素,反应物中的氧气中含有氧元素,故石蜡中一定含有 C、H元素.
(7)解:因为3.5g石蜡燃烧生成8.8g二氧化碳、5.4g水.所以根据质量守恒思想的元素守恒,则可知该石蜡中还有碳元素的质量为:8.8g× ×100%=2.4g,5.4g水里氢元素的质量为:5.4×
×100%=2.4g,5.4g水里氢元素的质量为:5.4× ×100%=0.6g,则碳元素和氢元素的质量共3.0g,小于3.5克石蜡的质量,所以一定有氧元素.
×100%=0.6g,则碳元素和氢元素的质量共3.0g,小于3.5克石蜡的质量,所以一定有氧元素.
(2)火柴火焰靠近蜡烛会看到蜡烛熔化,蜡烛点燃后会看到蜡烛先熔化后燃烧;根据此实验说明物理变化和化学变化的关系是化学变化中常常伴随着物理变化,物理变化中不包含化学变化.
(3)点燃蜡烛,观察到蜡烛火焰分为外焰.内焰.焰心三层,其中外焰燃烧最充分,温度最高,把一根火柴梗放在蜡烛的火焰中约1s后取出,可以看到火柴梗处在外焰层的最先碳化;
(4)熄灭燃烧的蜡烛,观察刚熄灭的蜡烛会产生一缕白烟,若用火柴火焰接触白烟,可以看到白烟能燃烧,蜡烛复燃;,原因是白烟是固态石蜡小颗粒;
(5)蜡烛燃烧生成二氧化碳,二氧化碳不能燃烧不能支持燃烧,密度比空气大,故会看到低处的蜡烛先熄灭,高处的蜡烛后熄灭;
(6)将一只干燥的烧杯罩在火焰上方,烧杯内壁出现水雾.片刻后取下烧杯,迅速向烧杯内倒入少量澄清的石灰水,振荡,澄清石灰水变浑浊,说明蜡烛燃烧生成水和二氧化碳,因为各元素在反应前后不变,水和二氧化碳中都含有碳、氢元素,反应物中的氧气中含有氧元素,故石蜡中一定含有 C、H元素.
(7)解:因为3.5g石蜡燃烧生成8.8g二氧化碳、5.4g水.所以根据质量守恒思想的元素守恒,则可知该石蜡中还有碳元素的质量为:8.8g×
 ×100%=2.4g,5.4g水里氢元素的质量为:5.4×
×100%=2.4g,5.4g水里氢元素的质量为:5.4× ×100%=0.6g,则碳元素和氢元素的质量共3.0g,小于3.5克石蜡的质量,所以一定有氧元素.
×100%=0.6g,则碳元素和氢元素的质量共3.0g,小于3.5克石蜡的质量,所以一定有氧元素.
练习册系列答案
相关题目