题目内容
【题目】某温度下,在一密闭容器中,将一定量的甲醇(CH3OH)和甲烷的混合气体与10.4 g氧气点燃发生反应(燃烧不充分),其产物经测定含有2.8 g CO、5.5 g CO2、8.1 gH2O(反应物无剩余)。求:
(1)若该混合气体充分燃烧还需多少克氧气?
(2)原混合气体含有甲醇多少克?
【答案】该混合气体充分燃烧还需1.6 g氧气;原混合气体含有甲醇4.8 g。
【解析】解:(1)设需要氧气质量为x,
2CO+O2 ![]() CO2
CO2
56 32
2.8g x
![]()
x=1.6g,
答:完全燃烧还要1.6克氧气;
(2)设甲醇质量为y,甲烷质量为z,
因为混合气体中碳元素的质量为:2.8g×![]() ×100%+5.5g×
×100%+5.5g×![]() ×100%=2.7g,
×100%=2.7g,
又因为甲醇和甲烷的混合气体质量为:2.8g+5.5g+8.1g-10.4g=6g,
根据题意有:y+z=6g,y×![]() ×100%+z×
×100%+z×![]() ×100% =2.7g,
×100% =2.7g,
y=4.8g, z=1.2g,
答:原混合气体中甲醇为4.8g。

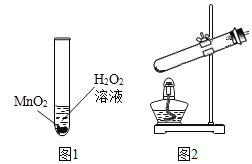
【题目】科学兴趣小组想研究影响过氧化氢(H2O2)分解速度的因素.在四支试管中分别加入0.2克二氧化锰(MnO2)粉末,然后加入等量的不同浓度的过氧化氢溶液,观察气泡产生的速度,记录如表:
实验次数 | 1 | 2 | 3 | 4 |
H2O2溶液的浓度 | 1% | 5% | 10% | 15% |
MnO2质量 | 0.2克 | 0.2克 | 0.2克 | 0.2克 |
气泡产生的速度 | + | ++ | +++ | ++++ |
(1)该实验研究的问题是:过氧化氢分解的速度与_____的关系.
(2)为了检验产生的气体是否为氧气,请你写出检验的方法:____________________.
(3)过氧化氢和二氧化锰制氧气的基本反应类型是_______反应.如果要说二氧化猛在该反应中起到催化作用,还需要通过实验验证二氧化锰在反应前后________不变.
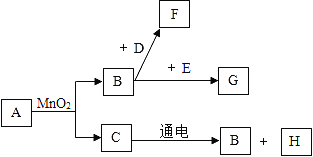
(4)同学通过查阅资料得知,双氧水在70℃以上会较快分解产生氧气.为了验征加热双氧水也可以产生氧气,同学们选择如图2装置(气密性良好)进行实验.实 验中观察到试管内产生气泡,但将带火星的木条放在导管口没有复燃,可能的原因是______________________.