题目内容
【题目】市售的“自热米饭”带有一个发热包,遇水后可迅速升温至150℃,保温时间达3小时,能将生米做成熟饭。某中学化学兴趣小组对发热包非常感兴趣,进行了以下探究。
(查阅资料)
(1)发热包主要由生石灰、铁粉、镁粉、铝粉、炭粉、氯化钠中的若干种组成;
(2)氢氧化镁和氢氧化铝均为不溶于水的白色固体,但后者可溶于NaOH溶液生成偏铝酸钠(NaAlO2)。请写出该反应的化学方程式_________________ 。
(成分探究)取出某品牌的发热包内灰黑色的固体粉末,分成两份。
(1)第一组同学用磁铁靠近其中一份粉末,发现有黑色物质被磁铁吸引,证明粉末中含有__________(填名称)。用磁铁将该物质全部吸出后,剩余粉末为样品A ;
(2)第二组同学将另一份粉末加水溶解、过滤后,取部分滤液滴入酚酞试液,滤液变红色,证明原粉末中含____________ (填化学式);再向滤液中加入含有稀硝酸的硝酸银溶液 ,看到___________,证明原粉末中含有氯化钠;
(3)除上述物质外,还可能存在镁粉、铝粉、炭粉,对此大家提出了以下几种猜想:
猜想一:只存在上述三种中的一种;
猜想二:上述三种同时存在;
猜想三:存在铝粉和炭粉;
猜想四:存在___________(填名称);
猜想五:镁粉和炭粉。
(实验验证)小施用样品A进行实验,流程如下。向滤液B滴加氢氧化钠溶液时,他观察到开始时有白色沉淀生成,后来又全部消失,最后得到的是无色溶液E。
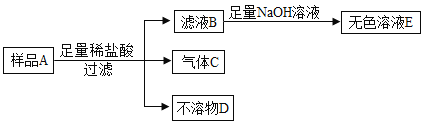
(实验结论)
(1)不溶物D是____________(填名称);
(2)大家结合实验现象讨论后,认为猜想_____________ 正确,理由是________________。
(原理探究)
第三组同学利用如图装置证明发热包放热主要来自于生石灰与水的反应。加水后发现A中温度迅速升高,B中有气泡产生,该气体为__________ (填名称)。但温度很快下降,说明该反应很快结束,不能长时间保温。

(猜想)大家大胆猜测应该还有其他放热反应存在。
(实验验证)
同学们按资料介绍,用铁粉、炭粉和食盐水在锥形瓶中模拟铁的锈蚀实验,不久后发现锥形瓶外壁微烫,并持续较长时间。该现象很好地解释了发热包的保温机理。
(拓展活动)
在上述铁的锈蚀实验中未观察到有红色的铁锈产生。老师告诉同学们,铁锈蚀的过程是首先生成一种碱,这种碱在空气中极易被氧化又变成另外一种碱,请写出生成另外一种碱的反应化学方程式_______________________ 。
【答案】Al(OH)3+NaOH=NaAlO2+2H2O 铁粉 CaO 有白色沉淀生成 镁粉与铝粉 炭粉 三 滤液B中加入足量NaOH溶液,最终得到无色溶液,说明B中不含Mg3+,即样品中不含镁粉;有气体C产生,最后得无色溶液,说明金属是铝粉;有不溶物D说明含炭粉 空气 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
1、查阅资料
(2)氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,故反应的化学方程式写为:Al(OH)3+NaOH=NaAlO2+2H2O。
2、成分探究
(1)铁粉能够被磁铁吸引,所以该粉末中能被磁铁吸引的黑色粉末是铁粉,故填铁粉;
(2)取部分滤液滴入酚酞试液,滤液变红色,证明滤液中含有碱性物质,粉末中可能存在的物质中的氧化钙能够与水反应生成氢氧化钙。氢氧化钙溶液呈碱性,所以粉末中肯定含有氧化钙,其化学式为CaO,故填CaO;
如果粉末中含有氯化钠,加入酸化的硝酸银溶液后,硝酸银与氯化钠反应生成硝酸钠与氯化银的白色沉淀,故填有白色沉淀生成。
(3)粉末中含有镁粉、铝粉、炭粉中的两种物质的情况有:镁粉与铝粉、镁粉与碳粉、铝粉与碳粉,故填镁粉与铝粉。
3、实验结论
(1)由反应关系图可知,不溶物D既不能与盐酸反应,也不溶于水,则D应为样品中的碳粉,故填碳粉。
(2)镁与盐酸反应生成氯化镁和氢气,氯化镁与氢氧化钠反应能够生成氯化钠和氢氧化镁的白色沉淀,滤液B中加入足量NaOH溶液,最终得到无色溶液,说明B中不含Mg2+,即样品中不含镁粉;有气体C产生,最后得无色溶液,说明金属是铝粉,有不溶物D说明含炭粉,即猜想三正确
4、原理探究
氧化钙与水反应生成氢氧化钙的同时释放热量,装置A中的空气受热膨胀,膨胀的气体通过导管进入装置A中的水中在导管口处形成气泡,所以装置B中产生的气泡中的气体是空气,故填空气。
5、拓展活动
铁元素形成的碱有氢氧化铁和氢氧化亚铁,其中氢氧化亚铁和氧气、水反应生成氢氧化铁,故反应的化学方程式写为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。

 口算题天天练系列答案
口算题天天练系列答案【题目】认识物质的组成和结构,进而能推知物质的性质和用途。
(1)原子结构决定元索性质。
2016年6月8日,国际纯粹与应用化学联合会正式发布113号等四种新元素的英文名称和元素符号。2017年5月9日,我国发布了这四种元素的中文名称。其中113号的元素符号为Nh,中文名称为“鉨”。如图甲、乙分别为鉨原子和铝原子结构示意图。请回答下列问题:
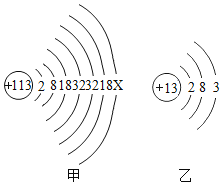
①在化学反应中,鉨原子形成离子的符号为________________。
②根据原子结构,理论上鉨的金属活动性比铝强,你认为可能的原因是________________。
(2)物质组成和结构决定其性质.性质决定其用途。
胃酸过多须服用抗酸药。下表为两种抗酸药的有效成分及其构成微粒:
抗胃酸药 | 复方氢氧化镁片剂 | 铝碳酸镁片 |
有效成分 | Mg( OH)2 | AlMg( OH)3CO3 |
构成微粒 | Mg2+、 OH- | Al3+、Mg2+、 OH-、 CO32- |
由于抗酸药有效成分不同,起抗酸作用(即消耗胃液中盐酸)的微粒也有差异。
①Mg( OH)2起抗酸作用的微粒是_______________(填微粒符号,下同);
②铝碳酸镁与盐酸反应的化学方程式为:![]() 。铝碳酸镁起抗酸作用的两种微粒是__________________________________。
。铝碳酸镁起抗酸作用的两种微粒是__________________________________。