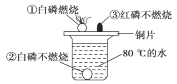
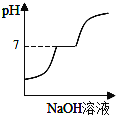
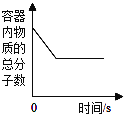
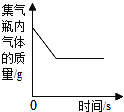
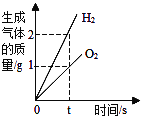
题目内容
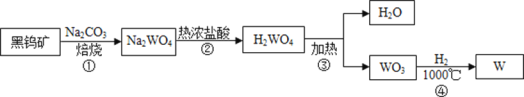
【题目】钨(W)是一种银白色金属,常温下,钨不与任意浓度的盐酸、硫酸、硝酸反应,可做白炽灯泡的灯丝。用黑钨矿(主要含有钨酸亚铁,化学式FeWO4,相对分子质量304)制得金属钨的工艺流程如下图所示(省略了部分除去杂质的过程):
(1)根据上述资料,可以推理得出钨金属的性质是_____(填编号);
A 硬度大 B 熔点高
C 常温下不易与氧气反应 D 能与硫酸亚铁溶液发生置换反应
(2)H2WO4的名称是______,它是一种不溶于水的黄色固体;
(3)上图所示金属钨的生产过程涉及的主要化学反应如下:
步骤①: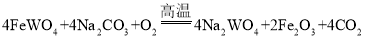
步骤②:把Na2WO4 溶液(无色)加入热的浓盐酸中,发生了复分解反应,则反应的化学方程式是_____,该反应中可能观察到的现象是_____;
步骤③:![]() ;
;
步骤④:该反应的化学方程式是_____;
(4)若工厂在生产过程中消耗了168 吨含钨酸亚铁75%的黑钨矿石,则理论上需要消耗氢气的质量为____吨(保留一位小数)。
【答案】BC 钨酸 ![]() 产生黄色沉淀
产生黄色沉淀 ![]() 2.5吨
2.5吨
【解析】
⑴根据上述资料,未涉及钨的硬度,故A无法判断;流程图中,1000℃时反应得到钨,故可推出钨的熔点高;常温下,钨可做白炽灯泡的灯丝,可以推出常温下不易与氧气反应;常温下,钨不与任意浓度的盐酸、硫酸、硝酸反应,可以推出钨排在氢的后面,故不能与硫酸亚铁溶液发生置换反应。因此可以推理得出钨金属的性质是:BC。
⑵根据含氧酸的命名规则,一般含氧酸命名为某酸,故H2WO4的名称是钨酸。
⑶步骤②把Na2WO4 溶液(无色)加入热的浓盐酸中,发生了复分解反应,则反应的化学方程式是![]() 又因为钨酸是一种不溶于水的黄色固体,故反应现象是产生黄色沉淀。步骤④的化学方程式是
又因为钨酸是一种不溶于水的黄色固体,故反应现象是产生黄色沉淀。步骤④的化学方程式是![]() 。
。
⑷这道题先根据化学式进行计算,得出最后得到的钨的质量,然后由钨的质量根据化学方程式计算求出氢气的质量。设理论得到钨的质量=![]() =76.3吨。
=76.3吨。
设需要消耗氢气的质量为x
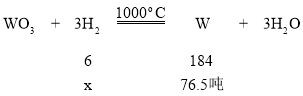
![]()
x=2.5吨
答:需要消耗氢气的质量约为2.5吨。

【题目】阅读资料并回答问题
钠(Na)是一种银白色金属,质软而轻,可用小刀切割,密度比水小,为 0.97g/cm3,熔点97.81℃,沸点 882.9℃。钠刚切开时,新切面有银白色光泽,但在空气中马上氧化转变为暗灰色。钠能与水发生剧烈反应生成氢氧化钠和氢气,量大时发生爆炸。钠还能在二氧化碳中燃烧,生成纯碱和一种气体氧化物。金属钠往往浸放于液体石蜡、矿物油和苯系物中密封保存。
(1)贮存金属钠时,用液体石蜡包裹的作用是______;
(2)金属钠在二氧化碳中燃烧的反应方程式是_______。铷(Rb)是一种银白色蜡状金属,化学性质与金属钠很相似,但比金属钠更活泼,遇水即在表面发生剧烈的反应并发生爆炸,该反应可表达为:
![]()
(3)推测溶液A中可能含有一种我们非常熱悉的离子____(填微粒符号),并设计3个不同的实验方案对此猜想进行验证。限选试剂:MgCl2溶液、CuSO4溶液、Na2CO3溶液、NaOH溶液、稀盐酸、酚酞溶液、紫色石蕊溶液、镁条、碳粉、氧化铁。
方案 | 验证预测的实验操作 | 预期现象 |
1 | 取少量溶液A于试管中,滴入____,振荡观察。 | 如果观察到___________则预测成立。 |
2 | 取少量溶液A于试管中,滴入____,振荡观察。 | 如果观察到___________则预测成立。 |
3 | 取少量溶液A于试管中,滴入_____,振荡观察。 | 如果观察到________________则预测成立。 |