题目内容
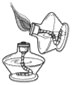
【题目】下图是电解水的实验装置图,请根据你所了解的知识填空:
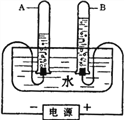
(1)通电一段时间后,试管A与试管B所收集到的气体体积比为_______,该实验的化学方程式为__________。
(2)实验室检验试管B中气体的方法是_________________。
(3)自来水中含有少量Ca(HCO3)2等可溶性化合物,烧水时Ca(HCO3)2发生分解反应,生成难溶性的碳酸钙、水和二氧化碳,这就是壶中出现水垢的原因之一。Ca(HCO3)2受热分解的化学方程式为_____________________________________。
【答案】 2:1 2H2O 通电 2H2↑+ O2 ↑ 将带火星的木条伸入试管B中,带火星木条复燃,说明是氧气 Ca(HCO3)2加热CaCO3↓+H2O+ CO2↑
【解析】试题分析:(1)A对应负极产生氢气,B为氧气,那么体积比为2:1;为水的电解反应;(2)B为氧气,将带火星的木条伸入试管B中,带火星木条复燃,说明是氧气;(3)由客观事实,根据质量守恒定律书写。

练习册系列答案
相关题目