题目内容
【题目】氯化钠和硝酸钾的溶解度曲线如图所示,请回答:
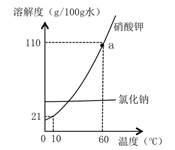
①图中a点的含义是______,60℃时,两物质中溶解度较大的是______;
②当硝酸钾中含有少量氯化钠时,可采用_______的方法提纯硝酸钾;
③将氯化钠的饱和溶液转化为同温下的不饱和溶液,可采用的方法是_______;
④如图所示,10℃时向硝酸钾溶液(底部有Xg硝酸钾晶体)中加入10g水并充分搅拌,恢复至10℃,正确的说法是______。

A.所得溶液一定饱和
B.溶质质量一定变大
C.溶质质量分数可能变大
D.若X< 2.1g,所得溶液不饱和
⑤工业上用电解饱和食盐水的方法制取氢氧化钠。反应原理是:
2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH。
H2↑+Cl2↑+2NaOH。
Ⅰ.该实验中正极产生的气体呈黄绿色,具有剌激性气味,该气体是_____(填“H2”或“Cl2”)。向电解后的溶液中滴加硫酸铜溶液,可观察到_____,证明反应生成了氢氧化钠。
Ⅱ.电解食盐水时,若有0.5molNaCl参加反应,生成氢氧化钠的质量是_______g。(根据化学方程式列式计算)
【答案】 60摄氏度时,硝酸钾的溶解度为110g/100g水 硝酸钾 降温结晶(冷却热饱和溶液) 加溶剂或加水 BD Cl2 蓝色絮状沉淀 20g
【解析】①图中a点的含义是60℃时,硝酸钾的溶解度为110g。60℃时,两物质中溶解度较大的是硝酸钾;②提纯溶解度受温度影响较大的物质,一般用降温结晶法。③饱和溶液转化为同温下的不饱和溶液,可采用的方法是加溶剂。④A.所得溶液不一定饱和,错误;B.加入的水可以溶解溶质,故溶质质量一定变大,正确;C.若X< 2.1g,所得溶液是不饱和溶液,溶质质量分数变小,错误;D.若X< 2.1g,所得溶液不饱和,正确。故选BD。⑤Ⅰ.氢气是无味的气体,氯气有刺激性气味,故填氯气。电解后的溶液中有氢氧化钠,2NaOH+CuSO4= Cu(OH)2↓+ Na2SO4,氢氧化铜是蓝色絮状沉淀。Ⅱ. 设生成氢氧化钠的质量是x,
2NaCl+2H2O 通电 H2↑+Cl2↑+2NaOH
2mol 80g
0.5mol x
![]() =
=![]() 解得x=20g
解得x=20g

 小学课时特训系列答案
小学课时特训系列答案