题目内容
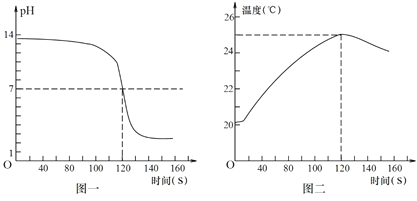
【题目】某小组运用数字化仪器进行实验,对中和反应中溶液的pH和温度进行实时测定:向含溶质0.1mol的氢氧化钠溶液中逐滴滴加稀盐酸(开始计时),用数字化仪器采集数据可得到溶液的pH随时间变化的曲线(如图一)、温度随时间变化的曲线(如图二)。
① 根据图一判断中和反应发生的依据是______,根据图二可知中和反应是_______反应(选填“吸热”或“放热”);最终所得溶液的溶质是________。
② 求实验中与0.1mol的氢氧化钠恰好完全反应的HCl的物质的量。(请根据化学方程式列式计算)_______。
③ 请在图三中画出该实验中生成氯化钠的质量随时间变化的曲线_______。

【答案】 溶液的pH明显下降直至小于7 放热 NaCl、HCl 0.1mol 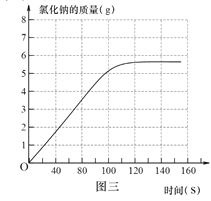
【解析】①根据图像分析解答;
②根据反应物、生成物及化学方程式计算解答;
③根据生成的氯化钠的质量及反应时间解答。
解:①由图一可知溶液的pH由明显大于7逐渐下降至明显小于7。根据图一判断中和反应发生的依据是:溶液的pH明显下降直至小于7;由图二可知溶液温度上升,根据图二可知中和反应是放热反应;由图一可知溶液的pH最终小于7,故最终所得溶液的溶质是反应生成的氯化钠和过量的稀盐酸,故填NaCl、HCl;
②设与0.1mol的氢氧化钠恰好完全反应的HCl的物质的量为x。
HCl+NaOH=NaCl+ H2O
1 1
x 0.1mol
![]()
x=0.1mol
答:实验中与0.1mol的氢氧化钠恰好完全反应的HCl的物质的量0.1mol。
③由图一可知反应结束时共花去120秒时间。氯化钠的质量不在增加。故实验中生成氯化钠的质量随时间变化的曲线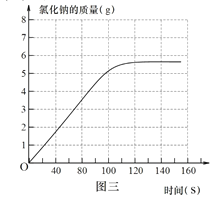

练习册系列答案
相关题目