题目内容
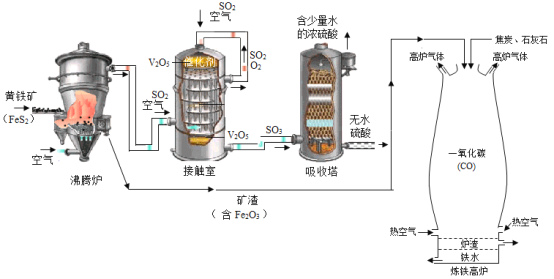
【题目】金属钛(Ti)抗腐蚀性能好,露置于空气中数年,仍光亮如初。以金红石(主要成分是TiO2)为原料生产金属钛的步骤主要有:①在高温下,向金红石与焦炭的混合物中通入氯气(Cl2),得到 TiCl4 和一种可燃性气体;②在稀有气体环境和加热条件下,用 Mg 和TiCl4 反应得到 Ti 和 MgCl2。下列说法不正确的是( )
A.①中的反应TiO2 +2C+2Cl2 TiCl4+2CO
TiCl4+2CO
B.②中的稀有气体的作用是隔绝空气,防止金属氧化
C.②中发生的反应为置换反应
D.金属钛在常温下极易与 O2 反应
【答案】D
【解析】
A、根据在高温下,向金红石与焦炭的混合物中通入氯气(Cl2),得到 TiCl4 和一种可燃性气体分析;
B、根据稀有气体的化学性质稳定分析;
C、根据置换反应的概念分析;
D、根据金属钛常温下化学性质稳定分析。
A、在高温下,向金红石与焦炭的混合物中通入氯气(Cl2),得到 TiCl4 和一种可燃性气体,反应①中的化学方程式为 ,故选项正确;
,故选项正确;
B、稀有气体的化学性质稳定,反应②中的稀有气体的作用是隔绝空气,防止金属被氧化,故选项正确;
C、在稀有气体环境和加热条件下,用 Mg 和TiCl4 反应得到 Ti 和 MgCl2,反应②是由一种单质与一种化合物反应生成另一种单质与另一种化合物,属于置换反应,故C选项正确;
D、金属钛抗腐蚀性能好,露置于空气中数年,仍光亮如初,说明其性质稳定,常温下不与氧气反应,故选项错误。
故选:D。

【题目】化学研究小组在开展了“过氧化氢制取氧气的反应中二氧化锰的作用”之后,又进行了“寻找新的催化剂”的探究实验。
(提出问题 1)寻找“氧化铁能否用于过氧化氢溶液分解的催化剂”的证据?如果能, 它的催化效果如何?
(实验设计 1)
实 验 | 现 象 |
Ⅰ.分别量取 5 毫升 5%的过氧化氢溶液于 A、B 两支试管中,向 A 中加入 a 克氧化铁粉末,并分别在 A、B 两支试管中伸入带火星的木条,观察现象。 | A 试管中产生气泡,带火星的木条复燃,B 试管中无明显现象 |
Ⅱ.将“实验Ⅰ”中 A 试管的剩余物质分离,将所得固体进行洗涤、干燥、称量 | 所得固体质量为 a 克 |
Ⅲ.将“实验Ⅱ”得到的固体放入盛有 5 毫升 5%的过氧化氢溶液的试管中,向试管中伸入带火星的木条 | 有气泡冒出,带火星的木条复燃 |
Ⅳ.分别量取 5 毫升 5%的过氧化氢溶液放入 C、D 两 支试管中,向 C 试管中加入 a 克氧化铁粉末,向 D 试管中加入 a 克二氧化锰粉末 |
(实验结论)
(1)A 中产生的气体是_____;
(2)氧化铁可以作过氧化氢分解的催化剂,寻找该结论的证据主要是设计了实验_____(选填Ⅰ、Ⅱ、Ⅲ或Ⅳ)展开的。
(实验评价)
(1)设计实验Ⅲ的目的是_____;
(2)可以用下列方法作出判断,从而达到实验Ⅳ的设计目的。a.定性判断:观察 C、D两支试管中产生气泡的快慢;b.定量判断:_____。
(资料信息)过氧化氢分解除了用二氧化锰还可用氧化铜等物质作为催化剂
(提出问题 2)氧化铜(黑色粉末)是否也能作氯酸钾分解的催化剂?它是否比二氧化锰效果更好?
(实验设计 2)某同学以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)。
实验序号 | 氯酸钾质量 | 其他物质质量 | 待测数据 |
① | 1.2 克 | X | |
② | 1.2 克 | 氧化铜 0.5 克 | Y |
③ | m | 二氧化锰 0.5 克 | Z |
(1)写出氯酸钾在二氧化锰的催化作用下发生的反应的化学方程式:_____。
(2)上述实验应测量的“待测数据”是指_____,从数学描述角度,X、Y、Z 在数值上的大小关系是_____。
(3)若实验②比实验①的“待测数据”更_____(填“大”“小”或“不确定”),说明氧化铜能加快氯酸钾的分解速率。表中“m”的数值应该为_____。
(4)将实验②反应后的固体经过过滤、洗涤、干燥处理后,称量得到 0.5 克黑色粉末, 再将黑色粉末放入_____(简述操作)。
(总结提高)二氧化碳可用于灭火,但不是所有可燃物失火都可以用二氧化碳来扑灭。