题目内容
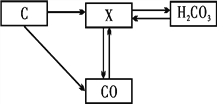
【题目】黄铁矿(主要成分为二硫化亚铁,FeS2)可用于工业制备硫酸(H2SO4),其所得矿渣中氧化铁(Fe2O3)含量较高,可用于高炉炼铁。其工业流程图如图所示:
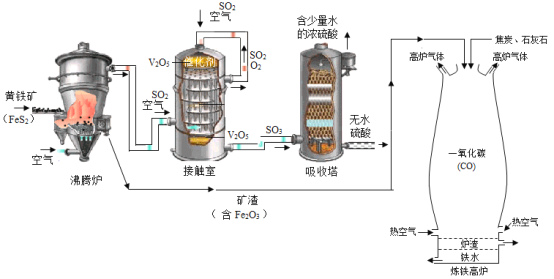
其中高炉炼铁的另两种原料分别为焦炭和石灰石(主要成分为CaCO3),其基本原理为:焦炭在高温下先转化为一氧化碳(CO),一氧化碳再与氧化铁(Fe2O3)在高温下反应制得铁。石灰石的作用是将杂质转化成炉渣除去。请回答下列问题:
(1)请将沸腾炉里的反应填写完整:4FeS2+11O2![]() 2Fe2O3+______。
2Fe2O3+______。
(2)黄铁矿粉碎的目的是______。
(3)将从接触室中排出来的SO2和空气重新送回接触室的目的是______。
(4)试写出炼铁高炉中一氧化碳炼铁的化学方程式______。
【答案】8SO2 增大黄铁矿与空气的接触面积,使其充分反应 充分利用原料,防止污染 3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
【解析】
(1)化学反应前后元素种类不变,原子个数不变,反应物中有4个铁原子、8个硫原子、22个氧原子,生成物中有4个铁原子、和6个氧原子,所以空白处是8SO2;
(2)黄铁矿粉碎的目的是:增大黄铁矿与空气的接触面积,使其充分反应;
(3)二氧化硫有毒,需要尾气处理,所以将从接触室中排出来的SO2和空气重新送回接触室的目的是:充分利用原料,防止污染;
(4)一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式为:3CO+Fe2O3![]() 2Fe+3CO2。
2Fe+3CO2。

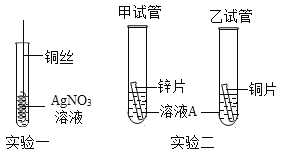
【题目】某兴趣小组同学利用下图所示装置进行“铝与硫酸铜溶液反应”的实验时,发现反应开始后试管中出现红色固体同时产生无色无味气体。兴趣小组同学进行了以下探究。

实验1:向5份相同体积的硫酸铜溶液中分别加入表面经过打磨处理的相同长度的铝条,现象如下:
实验组别 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
硫酸铜溶液浓度 | 24% | 12% | 8% | 6% | 5% | 3% | 1% |
气泡情况 | 很快 | 快 | 较快 | 快 | 较快 | 慢 | 无 |
实验2:向质量分数为8%的硫酸铜溶液分别加入表面经过打磨处理的相同长度的铝条,现象如下:
实验组别 | ① | ② | ③ | ④ | ⑤ |
水浴温度(℃) | 20 | 30 | 40 | 50 | 60 |
气泡情况 | 较快 | 快 | 很快 | 很快 | 很快 |
(1)实验1的目的是______。
(2)实验2的结论是______。
(3)依据实验1和实验2,推测50℃ 5% 硫酸铜溶液与铝条反应的现象是________。
(反思与评价)
(4)实验2没有进行温度为70℃的实验,理由是_______。
(5)根据你的猜想,气泡中的气体是______。
【题目】电影《流浪地球》中,人类靠点燃氧气与氢气混合气体的方法产生大量的能量,能量所带来的冲击波成功把地球推离危险轨道。小金想探究“氢气在空气中的爆炸极限”。他了解到可燃性气体都有爆炸极限,低于爆炸下限时不爆炸也不着火,高于爆炸上限时不会爆炸会燃烧。他在老师指导下设计并完成了如下实验:
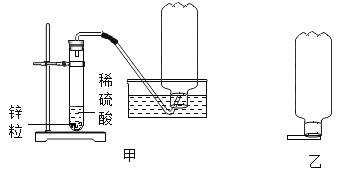
步骤1:利用实验室制取氢气类似的装置,如图甲,用矿泉水瓶收集体积分数分别是5%~100%的氢气若干瓶;
步骤2:将瓶子倒扣后打开瓶塞,架在火柴梗上,如图乙,用另一根火柴点燃氢气,实验现象如表:
H2体积分数/% | 5 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
点燃时的现象 | 不燃不爆 | 弱 爆炸 | 强 爆炸 | 强 爆炸 | 强 爆炸 | 强 爆炸 | 强 爆炸 | 弱 爆炸 | 安静燃烧 | 安静燃烧 |
(1)步骤1中收集一瓶体积分数为50%氢气的方法是______;
(2)根据实验现象,氢气在空气中的爆炸极限是______;
(3)小金觉得上述结论的范围还可以更加精确,下一步操作是______。