题目内容
为测定某盐酸中溶质的质量分数,小荣同学取该盐酸样品50g,向其中加入过量锌粒,完成反应后收集到0.3g氢气,请完成下列计算与分析:
⑴计算该盐酸中溶质的质量分数。
⑵小荣将测定结果与盐酸试剂瓶标签上所标的相关信息(浓盐酸、溶质的质量分数为35%)进行对比,发现标签上溶质的质量分数与实际测得的值不符(实验过程无误),你认为原因可能是 。
⑴计算该盐酸中溶质的质量分数。
⑵小荣将测定结果与盐酸试剂瓶标签上所标的相关信息(浓盐酸、溶质的质量分数为35%)进行对比,发现标签上溶质的质量分数与实际测得的值不符(实验过程无误),你认为原因可能是 。
(1)21.9%;(2)浓盐酸具有挥发性
50g样品中的盐酸完全反应产生氢气0.3g,据此可计算出样品中HCl的质量,然后进一步算出盐酸的溶质质量分数,盐酸具有按发性,由于氯化氢的挥发使溶液的溶质质量分数变小。
(1)解:设该盐酸中溶质的质量分数为x,
Zn+2HCl=ZnCl2+H2↑
2
X 0.3g
X=10.95g
该盐酸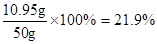
答:该盐酸中溶质的质量分数为21.9%
(1)解:设该盐酸中溶质的质量分数为x,
Zn+2HCl=ZnCl2+H2↑
2
X 0.3g
X=10.95g
该盐酸
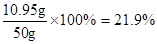
答:该盐酸中溶质的质量分数为21.9%

练习册系列答案
相关题目

 Fe+ 。
Fe+ 。 


 2 KCl + 3O2↑)
2 KCl + 3O2↑)