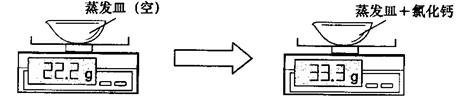
题目内容
将100g氯化钾样品(含有碳酸钾)加入50g盐酸中完全反应,气体全部逸出,得到145.6g溶液。则:
(1)产生的气体质量为________g。
(2)计算样品中氯化钾的质量分数。
(1)产生的气体质量为________g。
(2)计算样品中氯化钾的质量分数。
(1)4.4
(2)解:设样品中碳酸钾的质量为x
K2CO3+2HCl=2KCl+CO2↑+H2O
38 44
x 4.4g
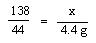
x=13.8g
氯化钾的质量为100g-13.8g="86.2" g
样品中氯化钾的的分数为:(86.2 g÷ 100g)×100%=86.2%
答:样品中氯化钾的质量分数为86.2%
(2)解:设样品中碳酸钾的质量为x
K2CO3+2HCl=2KCl+CO2↑+H2O
38 44
x 4.4g
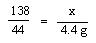
x=13.8g
氯化钾的质量为100g-13.8g="86.2" g
样品中氯化钾的的分数为:(86.2 g÷ 100g)×100%=86.2%
答:样品中氯化钾的质量分数为86.2%
化学反应前后物质减少的质量就是逸出二氧化碳的质量100g+50g—145.6g="4.4" g;根据K2CO3+2HCl=2KCl+CO2↑+H2O中二氧化碳的质量可以求出碳酸钾的质量,从而求出氯化钾的质量及在样品中所占的质量分数。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目