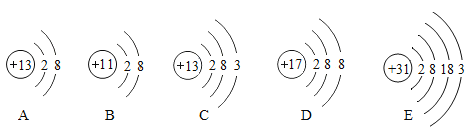
题目内容
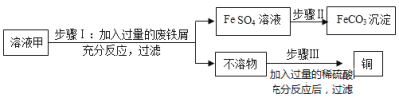
【题目】为了测定金属镁样品中镁的质量分数(杂质不含镁元素,不溶于水,也不与其它物质发生反应),进行了如下实验:请回答下列问题:
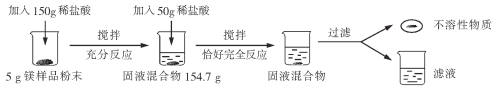
(1)上述实验过程中发生反应的化学方程式为________________________________。
(2)根据已知条件列出求解第一次所加的稀盐酸中溶质质量(x)的比例式________________。
(3)此镁样品中镁的质量分数为________________。
(4)用36.5%的浓盐酸配制200g上述稀盐酸,所需浓盐酸的质量为________________。
(5)若将反应后的滤液蒸发104.4g水,无晶体析出,所得溶液中溶质的质量分数为__________。
(6)若要生产含镁4.5%的铝合金960t,需要上述金属镁样品的质量为________________。
【答案】Mg+2HCl=MgCl2+H2↑ ![]() 96% 40g 19% 45t
96% 40g 19% 45t
【解析】
(1)实验过程中发生反应是镁和盐酸反应生成氯化镁和氢气,对应的化学方程式为 Mg+2HCl=MgCl2+H2↑。
(2)由于所加盐酸为同一盐酸,且根据第一次150g稀盐酸完全反应生成氢气为0.3g,所以继续加入50g稀盐酸恰好完全反应,则生成的氢气的质量总量为0.4g
第一次所加的稀盐酸中溶质质量为x
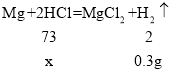
![]()
(3)设镁样品中镁的质量分数为y,消耗的盐酸的质量分数为z,生成的氯化镁的质量为a
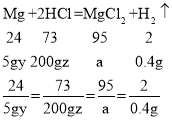
![]()
(4)用36.5%的浓盐酸配制200g上述稀盐酸,所需浓盐酸的质量为![]()
(5)若将反应后的滤液蒸发104.4g水,无晶体析出,所得溶液中溶质的质量分数为![]()
(6)若要生产含镁4.5%的铝合金960t,需要上述金属镁样品的质量为![]()
故答案为:
(1)Mg+2HCl=MgCl2+H2↑。
(2)![]() 。
。
(3)96%。
(4)40g。
(5)19%。
(6)45t。

【题目】抛撒融雪剂和消融路面积雪,研究人员配制出A、B两组融雪剂,组成成分及质量分数如下表
A组 | B组 |
CH3COOK 36% KHPO414% CaC12 14% MgC12 36% | CH3COOK 40% KH2PO4 14% CaC12 15% KHCO3 31% |
回答下列问题
(1)A、B两组融雪剂相比较,________组的CH3COOK(乙酸钾)含量高
(2)KH2PO4的相对分子质量为__________
(3)B组融雪剂中,含氯的质量分数为__________(填计算结果)。