题目内容
【题目】某化学兴趣小组欲测定某铁粉混合物中铁的质量分数,他们进行了如图所示的实验。请计算:
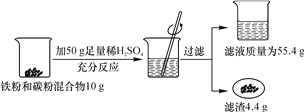
(1)混合物中铁的质量;
(2)反应后烧杯中稀硫酸无剩余,请计算所用稀硫酸中溶质的质量分数;
(3)欲用98%的浓硫酸配制该浓度的稀硫酸200 g需要水多少克?
【答案】(1)5.6 g;(2)19.6%;(3)160 g
【解析】(1)铁粉混合物中的铁粉与稀硫酸反应,碳粉不与稀硫酸反应,反应后减少的质量是生成氢气的质量,生成氢气的质量是:10 g+50 g-55.4g-4.4 g=0.2g
设铁粉混合物中铁粉的质量为x,
Fe+ H2SO4 == FeSO4 + H2↑
56 2
x 0.2g
![]() =
=![]() ,解得x=5.6g
,解得x=5.6g
(2)设所用稀硫酸中溶质的质量分数为y
Fe+ H2SO4 == FeSO4 + H2↑
98 2
50g×y 0.2g
![]() =
=![]() ,解得y=19.6%
,解得y=19.6%
(3)设欲用98%的浓硫酸配制该浓度的稀硫酸200 g需要水的质量是a,
200 g×19.6%=(200 g-a)×98%,解得a=160 g

练习册系列答案
相关题目
【题目】20℃时,将量的氯化钠固体分别放入100 g水中,充分溶解后过滤,所得溶液质量与加入氯化钠质量的对应关系如下表.其中所得溶液一定属于饱和溶液的是
A | B | C | D | |
加入食盐质量/g | 10 | 20 | 30 | 40 |
所得溶液质量/g | 110 | 120 | 130 | 136 |
A.A B.B C.C D.D