��Ŀ����
����Ŀ��̼���ƹ㷺������ֽ����֯��������ϴ�Ӽ����������Ƹ�ȹ�ҵ����һ����Ҫ�Ļ���ԭ�ϡ�������������ά�ͺ�°�Ϊ̼���ƵĹ�ҵ�����������˾��ס�
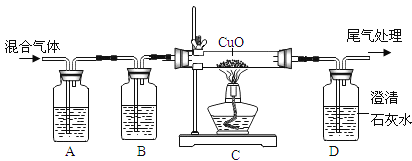
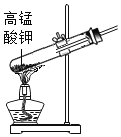
I������������1789�꣬����ҽ����������N��Leblanc��1742��1806����ʳ�Ρ�Ũ���ᡢľ̿��ʯ��ʯΪԭ�ϣ������˹�ģ����ҵ��ȡ̼���Ƶ��Ⱥӣ�����������ͼ��
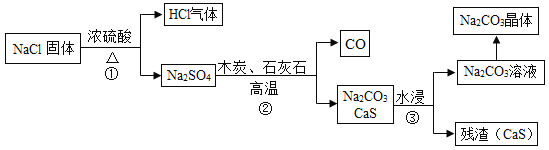
��1��̼�����׳�_____��
��2���ڸ��������£����з���������Ӧ������һ����Na2SO4��ľ̿����Na2S��CO���÷�Ӧ�Ļ�ѧ����ʽΪ_____��
��3�����С�ˮ����ʱͨ����Ҫ���裬��Ŀ����_____��
��4�������п�ѧ�Ҷ������������иĽ�������Ϊ�˷������Բ��㣬��д��һ������֮��_____��
��������ά����1892�꣬����ʱ����ʦ����ά���������̼���ƣ��ֳ�����ά����ԭ�����£�NaCl+NH3+CO2+H2O�TNaHCO3��+NH4Cl��2NaHCO3![]() Na2CO3+CO2��+H2O��
Na2CO3+CO2��+H2O��
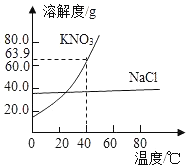
ij��ȤС���������װ��ģ������ά���Ʊ�̼�����ƣ������Ƶ�̼���ơ�
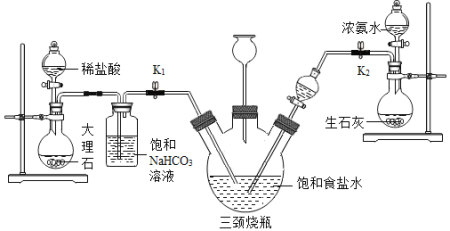
ʵ��������£�
�ٹر�K1����K2ͨ��NH3�������������ʣ������ȶ���K1ͨ��CO2��
�ڴ�������ƿ�ڳ��ֽ϶����ʱ���ر�K2ֹͣͨNH3��һ��ʱ��ر�K1ֹͣͨCO2��
�۽�������ƿ�ڵķ�Ӧ�������ˡ�ϴ�ӡ����¸���������ù�����ȵõ��ϴ���̼���ơ�
��5��װ���б���NaHCO3��Һ�������dz�ȥCO2�л��е�HCl����Ӧ�Ļ�ѧ����ʽΪ_____��
��6��װ����������ƿ�����ӵij���©������Ҫ������_____����ͬѧ��ΪӦ���ڳ���©���ڷ���һ��պ����Һ������������_____
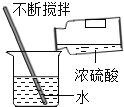
��7��ʵ�������Ũ��ˮ������ʯ���Ͽ��Եõ�����������ԭ����_____��������ȡ�������ŵ���_____��
�����Ƽ���ںܳ�һ��ʱ���ڰѳ���Ӣ�����������������С��ԡ��Ƽ��˰ʵҵ�ȹ���Ϊ�������ҹ���ѧ����ר�Һ�°�������������������ά�����������ڣ�����1943�괴���Եؽ��Ƽ����ư����ֹ�����������������������������ŷţ�ͬʱ������̼���ƺ��Ȼ�����ֲ�Ʒ������������ĺ����Ƽ��
���𰸡�����/�մ� Na2SO4+4C![]() Na2S+4CO�� ʹ��Ӧ���ֽӴ��������ڳ�֡�Ѹ�ٷ�Ӧ ������һ����̼�ж�������Ⱦ���� NaHCO3+HCl=NaCl+CO2��+H2O ƽ��װ������ѹ ���ⰱ���ݳ���Ⱦ���� ��������ˮ��Ӧ�ų������ȣ������˶��ӿ죬ʹ�ð�ˮ�ӷ����������� �������
Na2S+4CO�� ʹ��Ӧ���ֽӴ��������ڳ�֡�Ѹ�ٷ�Ӧ ������һ����̼�ж�������Ⱦ���� NaHCO3+HCl=NaCl+CO2��+H2O ƽ��װ������ѹ ���ⰱ���ݳ���Ⱦ���� ��������ˮ��Ӧ�ų������ȣ������˶��ӿ죬ʹ�ð�ˮ�ӷ����������� �������
��������
��1��̼�����׳�Ϊ������մ�
��2���ڸ��������£�Na2SO4��ľ̿����Na2S��CO����Ӧ�Ļ�ѧ����ʽΪNa2SO4+4C![]() Na2S+4CO����
Na2S+4CO����
��3�����е�̼���ƺ��ƻ�Ͻ��С�ˮ����ʱͨ����Ҫ���裬��Ŀ����ʹ��Ӧ���ֽӴ��������ڳ�֡�Ѹ�ٷ�Ӧ��
��4���������������Բ��㣬����̼�и����������������Ʒ�Ӧ������һ����̼�ж�������Ⱦ����������Ũ�������Ȼ��Ʒ�Ӧ���������Ȼ������壬��Ⱦ������
��5���ñ���NaHCO3��Һ��ȥCO2�л��е�HCl���Ȼ�����������ˮ������ᣬ������̼�����Ʒ�Ӧ�����Ȼ��ơ�ˮ�Ͷ�����̼���壬��ѧ����ʽΪNaHCO3+HCl=NaCl+CO2��+H2O��
��6��װ����������ƿ�����ӵij���©�����������ͨ����������Ҫ������ƽ��װ������ѹ������ƿ����ѹ����ƿ���������ڳ���©���ڷ���һ��պ����Һ�������������հ��������ⰱ���ݳ���Ⱦ������
��7��ʵ�������Ũ��ˮ������ʯ���Ͽ��Եõ�����������ԭ������������ˮ��Ӧ�ų������ȣ������˶��ӿ죬ʹ�ð�ˮ�ӷ�������������������ȡ�������ŵ��Dz�����㡣

 �·Ƿ��̸����100��ϵ�д�
�·Ƿ��̸����100��ϵ�д�����Ŀ��ij�ѧʵ��ν�������ε�����ʵ�顣
��ʵ��һ���������ָʾ��
��1��ȡ�����ϰ��˺Ͱײ�Ҷ�����ֱ����в��е��ã�����ƾ���Һ���ݣ���ɴ�������ݳ���֭Һ�˳����۲쵽�ϰ���֭ҺΪ��ɫ���ײ�֭ҺΪ��ɫ���ֱ�װ�ô��á�
��2��ȡ��֧�Թֱܷ���NaOH��Һ��ϡ�������ʵ�飬�۲쵽������ͼ��

��¼���£�
NaOH��Һ | ϡ���� | |
�ϰ���֭Һ | ����ɫ | �ں�ɫ |
�ײ�֭Һ | ����ɫ | �ܵ���ɫ |
����Ϊ����֭Һ�У����ʺ������ָʾ������ ��
��3������ƻ��֭������ͬʵ�飬�ϰ���֭Һ���ɫ���ײ�֭Һ�䵭��ɫ����ƻ��֭��Һ�� �ԡ�
��ʵ�����̽�������ε�����
��һ��ѧ������CuSO4��NaOH��Һ�ķ�Ӧ���۲쵽�������� ���÷�Ӧ�Ļ�ѧ����ʽΪ ��
�ڶ���ѧ������BaCl2��Na2CO3��Һ�ķ�Ӧ����Ӧ�Ļ�ѧ����ʽΪ ��
��ʵ��������Һ��̽��
��ʵ���������������ͬѧ��ȫ���ķ�Һ���е���һ����Һ���С���ȤС��ͬѧ�Է�Һ���й��ˣ��õ���ɫ��Һ��
��������⡿
��Һ�к���ʲô���ʣ�
���������롿
��Һ��һ������ �������ܺ���BaCl2��NaOH��Na2CO3��Na2SO4�е�һ�ֻ��֡�
��ʵ��̽����
��1��ȡ������Һ�����Թ��У��μ��ϰ���֭Һ����Һ����ɫ��
��2����������������ϡ���ᣬ��Һ��ɺ�ɫ�������ݺͳ�������������Һ��һ��û�� �����ݣ�1����2���ж���Һ��һ������ ��
��3��Ϊ����ȷ������Һ����ɣ����貹���ʵ���ǣ� ���۲쵽��ɫ������
��ʵ�������� ����ɫ��Һ�����Ϊ ��